|
|
Zusammengestellt
von: A. Hartwig / Febr. 2004 / © all rights for this
home-page are reserved by web-master
|
|
|
|
Die
web-site, bzw. home-page wurde mit StarOffice 5.2 und SuperHTML
5.0 erstellt
|
|
|
|
URL:
https://www.borreliose-zecken-ms.de/
|
|
|
|
zuletzt
aktualisiert: 7/2016
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Neuro-Borreliose
(NB) und Multiple
Sklerose (MS) ein
Zusammenhang?
|
|
|
|
|
|
>>
Das MS-Syndrom wird unter Medizinern auch als
Encephalomyelitis disseminata (ED)
bezeichnet <<
|
|
|
|
|
|
Das
Lesen dieser Seite ersetzt keinen Arztbesuch, eine Behandlung des
MS-Syndroms gehört in die Hand von entsprechenden fachlich
kompetenten Medizinern (z.B. Neurologen).
|
|
|
|
|
|
|
|
|
|
|
|
Die Diagnose
Multiple Sklerose (MS) gilt
allgemein unter Neurologen als nicht einfach, i.d.R. wird sie
aber trotzdem meist zu schnell gestellt ohne genügend
ansteckende und andere Infektionskrankheiten sowie neurotoxische
Faktoren (z.B. Zahnfüllungen
aus Amalgam) auszuschließen. Es
sollte auf jedem Fall nachfolgende genannte Krankheiten mit
allen Regeln der ärztlichen Kunst ausgeschlossen
(Differential-Diagnostik) werden
und z.B. auch ein Blick in den Mund geschehen, zwecks
Überprüfung auf neurotoxische Zahnfüllungen
(z.B. Amalgam), bevor die
Syndrom-Verlegenheits-Diagnose Multiple Sklerose (MS)
gestellt wird. Ansonsten droht ggf. eine
Falsch-Behandlung, die eventuell sogar das Fortbestehen eines der
nachfolgend benannten (ggf. auch noch
andere) Infektionskeime begünstigt.
Entzündungshemmer verbessern i.d.R. zwar recht schnell die
vom Patienten wahrgenommene Symptomatik, begünstigen aber
eventuell auch die schleichende Ausbreitung des nicht erkannten
Infektionskeims. Langfristig führt eine solche
Falsch-Behandlung dann sehr wahrscheinlich eher zur
Verschlechterung des gesundheitlichen Zustandes, sobald ein
entsprechender Infektionskeim-Schwellenwert überschritten
wird und eine hierdurch bedingte Entzündung auch nicht mehr
mit Entzündungshemmern erfolgreich unterdrückt werden
kann. Liegt eine virale oder durch Bakterien bedingte Infektion
vor, dann ist sicherlich eine entsprechende Antibiose
(Kombi-Antibiose bzw. Omnispektrumtherapie)
oder antivirale Behandlung angebrachter - ggf. mit
entzündungshemmender Nachbehandlung um eine sich selbst
unterhaltende Autoaggression im Keim zu ersticken.
|
|
|
|
|
|
Die allgemein
ungenügend differentialdiagnostisch abgegrenzten
Erkrankungen sind folgende:
|
|
|
|
|
|
(Quelle
z.B.: [107/97])
|
|
|
|
|
|
(Lyme-)Borreliose
(Borrelia
burgdorferi sl.-komplex),
Katzen-Kratz-Krankheit (Bartonella hensellae),
atypische Lungenentzündung (Mycoplasma;
insbes. M.
pneumoniae),
atypische Lungenentzündung u./o.
Arteriosklerose (?)
(Chlamydia
pneumoniae),
Drei-Tage-Fieber (Humane
Herpesvirus 6 / HHV-6),
Leberentzündung Typ C (Hepatitis-C-Virus),
Whipple´sche Krankheit (Morbus-Whipple
Krankheit: Tropheryma whippelii), Syphilis
(Treponema pallidum), HIV /
AIDS (AIDS-assoziiertes-Retrovirus;
z.B: HIV-1 u. HIV-2 / humanes immunodeficiency virus),
Mittelmeer-, Gibraltar- oder Maltafieber (Burcelliosis),
Mittelmeer-Flecken-Fieber (Riketssia
connore u./o. Leptospira serovars)
sowie ggf. auch Creutzfeldt-Jakob Krankheit
(CJK/CJD/vCJD/sCJD: Prionen).
Muskelentzündung - sporadische Einschlusskörpermyositis
(andauernder
Zellstress, Ausschüttung des Stressmoleküls NO mit der
Folge Bildung von Beta-Amyloid).
|
|
|
|
|
|
Eine Abgrenzung
und ggf. Diagnostik einer der vorab genannten Erkrankungen sollte
in jeden Fall frühzeitig geschehen, auch wenn die Symptome
noch recht schwach ausgeprägt sind. Je eher erkannt und
Erkrankungs-spezifisch behandelt, um so geringer die Gefahr das
eine der Erkrankungen einen autoaggressiven Verlauf nimmt –
z.B. Multiple Sklerose / MS-Syndrom.
|
|
|
|
|
|
|
|
|
|
|
|
Fakten zum
MS-Syndrom kurz zusammengefasst (Stand
2013):
|
|
|
|
|
|
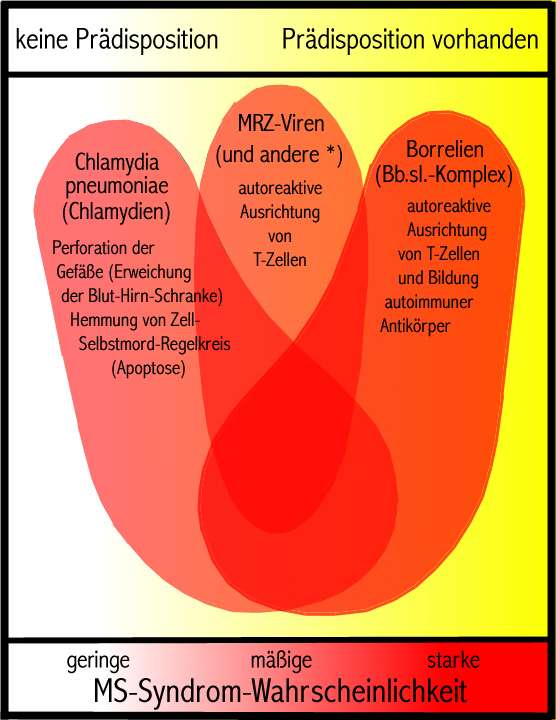
- Faktor 1: das
MS-Syndrom tritt nur bei Menschen auf die eine genetische
Prädispositin aufweisen! Hierbei handelt es sich um eine
kurze Form des sogenannten
Tumornekrosefaktors (TNF).
Diese
TNF-Genvariante macht die Andockstelle des Tumornekrosefaktors
(TNF) löslich, wodurch in Folge
dieses wichtige Signalmolekül blockiert wird und es zu den
typischen Entzündungsherden kommt [112].
|
|
|
|
|
|
- Faktor 2:
die Myelinschäden haben keine
neurodegenerative Ursache ohne Immunsystembeteiligung, sie sind
nicht der initiale Auslöser der autoaggressiven
Immunreaktion, sondern die Folge durch eine falsche
Immunausrichtung (z.B.
durch Schwermetalle, Borrelien, Chlamydien etc.)
gegen Körpereigen (Selbst-Antigen).
Die neurodegenerative These gilt inzwischen als widergelegt [111]!
|
|
|
|
|
|
- Faktor 3:
Borrelien
(nachgewiesen an Bb. ss. bzw. B31)
setzen sich zu circa 25-30 % aus Fette u. fettähnliche
Stoffe (sogen. Lipoiden)
zusammen, die massenspektrometrisch und
gaschromatographisch in 11 Lipidfrak-tionnen aufgetrennt
bzw. klassifiziert werden konnten. Es konnte nur zweien,
von den 11 klassifizierten Lipidfraktionnen (beides
sogenannte Glykolipide), eine antigene Wirkung beim
Menschen nachgewiesen werden [115].
Bei den anderen Borrelia-Lipiden (Fetten)
muss daher davon ausgegangen werden, dass sie den menschlichen
Lipiden sehr ähnlich sind und normalerweise zu keine
Immunreaktion führen. Allerdings sollen einige
Lipoproteine der Borrelien toxische Wirkung besitzen [116].
|
|
|
|
|
|
-
Faktor 4: Als gesichert gilt inzwischen das durch die sogenannten
Galaktolipide der Borrelien (Bb.sl.-Komplex)
eine autoreaktive Antikörperbildung ausgelöst werden
kann, welche man mit folgender Kurzbezeichnung benennt: GM1,
GD1b und GT1b [60]. Diese
Antikörper sind allesamt Autoimmun-Antikörper, die sich
vor allem kreuzreaktiv gegen die Plasmamembran der
Nervenzellen (Gangliosid) richten
und dort insbesondere an deren Einschnürungen bzw.
Unterbrechungen der Markscheiden (Ranvierschen
Knoten) Entzündungen verursachen. Die
Borrelien-Galaktolipide können aber
auch direkt zur Aktivierung von Makrophagen führen,
die dann Entzündungen an den Gliazellen hervorrufen [10]
(siehe
auch Fakt(or) 7 oder unten Kap. “Möglicher
Zusammenhang Borrelia burgdorferi (Bb.sl.-Komplex) und MS-Syndrom
kurz zusammengefasst“).
|
|
|
|
|
|
- Faktor 5:
durch andauernden Zellstress (Muskel-
u. Nervenzellen etc.) schütten diese in
Folge ggf. das Stressmolekül Stickoxid (NO)
aus. Folge: unspezifische Isolier- u. Reparaturversuche mittels
Beta-Amyloid. Es
konnte eindeutig gezeigt werden, chronische Entzündungen im
ZNS können die Bildung von Beta-Amyloid-Plaques auslösen,
somit das Alzheimersyndrom / DAT (Stand
2012 [293]).
|
|
|
|
|
|
- Fakt(or)
7: Es
konnte bewiesen werden, bei Multiple Sklerose (MS
bzw. ADEM) und Alzheimer (DAT)
liegen ähnliche Aktivierungsmuster
der Mikroglia-Zellen (Makrophagen des
ZNS) vor [113].
|
|
|
|
|
|
- Fakt(or)
8: Inzwischen wurden
atypische und zystische Borrelien in Zusammenhang mit
Alzheimer (DAT)
histologisch und immunchemisch nachgewiesen [114].
|
|
|
|
|
|
- Fakt(or)
9: >>Die
positive Identifizierung der Erreger als B. burgdorferi s.s.
basierte auf genetischen und molekularen Analysen. Borrelia
Antigene und Gene wurden an den gleichen Stellen wie die
beta-amyloiden Ablagerungen festgestellt. („co-localized“)
Diese Daten zeigen, dass Borrelia burgdorferi im Gehirn
persistieren kann und in Verbindung gebracht werden kann
mit amyloiden Plaques bei Morbus Alzheimer.<< (zitiert
aus [114]).
|
|
|
|
|
|
|
|
|
|
|
|
- Fazit: Das
MS-Syndrom ist somit keine rein genetische Erkrankung, sondern
vielmehr sorgt die Gen-Variante des kurzen TNF für eine
Empfänglichkeit
(sogen. Prädisposition). Tritt
Faktor 2 nicht ein (z.B. Borreliose),
dann kommt es auch zu keiner MS-Syndrom-Erkrankung. Faktor 2
alleine führt allerdings auch nicht zur persistierenden
Syndrom einer MS, beide Faktoren zusammen führen erst zum
MS-Syndrom. Umso wichtiger ist eine Früherkennung einer der
in Frage kommenden Initial- o. Primärerkrankungen!
|
|
|
|
|
|
These
(A. Hartwig): bei chronischer
ZNS-Entzündung tritt entweder das Multiple Sklerose,
Alzheimer oder eine andere Verlaufsform ein.
|
|
|
|
|
|
1. Variante:
MS-Syndrom,
bedingt durch Prädisposition der kurzen TNF-Genvariante.
Hierbei werden überschießend auch körpereigene
Lipide mit abgebaut. Eventuell bedingt dadurch weil die
Borrelia-Lipide dem menschlichen Lipiden sehr ähnlich sind
(siehe oben Faktor 3).
|
|
|
|
|
|
2. Variante:
Alzheimer
(DAT),
bedingt durch unspezifische Reparatur-Versuche ausgelöst
durch NO-Zell-Stress-Reaktionen. Hierbei kommt wegen fehlender
TNF-Prädisposition nicht zu solch autoreaktiv überschießenden
Reaktionen wie beim MS-Syndrom, aber eben auch nicht zur
vollständigen Beseitigung der dem Menschen ähnlich
Borrelia-Lipiden. Hierbei bilden die Borrelia-Lipid-Rückstände
zusammen mit den Zelle-Stress bedingten Reaktionen eventuell die
Alzheimer-typischen Beta-Amyloid-Plaques
(siehe
oben Faktor 3, 5, 8 u. 9).
|
|
|
|
|
|
3. Variante:
eine andere
Verlaufsform, z.B. akute Neuroborreliose
mit für Borrelien spezifischen Antikörpern da der
Patient keinerlei genetisch bedingte Prädisposition gegenüber
den Borrelien aufweist.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Der Weg zur
Autoimmunität bzw. autoaggressiven Verhalten der Immunzellen
am Beispiel der T-Zellen.
|
|
|
|
|
|

Selektion
von Autoimmun-T-Zellen (Vortragsfolie von A. Hartwig / Mai 2009)
|
|
|
|
|
|
|
|
|
|
|
|

Autoimmunkrank
durch Borrelien? (Vortragsfolie von A. Hartwig / Mai 2009)
|
|
|
|
|
|
|
|
|
|
|
|
Das Militärische
Institut für Molekulare Mikrobiologie (ILADS-Kongress
2008 [97]),
welche mit der Untersuchung des Golfkriegssyndrom 1 (Gulf
War I-Syndrom) beauftragt war hat bzgl. der von ihnen
untersuchten MS-Patienten folgendes festgestellt: 50 Prozent der
MS-Patienten waren mit Mykoplasmen, 15 Prozent mit Chlamydien und
35 Prozent mit Borrelien infiziert. Die Zahlen bestätigen
im Prinzip meine unten geäußerten Verdacht das sich
circa hinter einen Drittel der MS-Patienten in Wirklichkeit eine
Neuro-Borreliose verbiergt. Ich würde daher als Patient
eine entsprechende gründliche Diagnostik fordern, zumal alle
diese Keime z.B. mittels Doxyciclin-Kombitherapie erreichbar sind.
Allerdings nicht nur lieblos probiert, was häufig gemacht
wird um ein nicht Ansprechen der Antibiose zu beweisen, sondern
ausreichend hoch und lange. In Bezug auf die
Borrelien-Diagnostik bedeutet dies, es sollten nicht
nur ein Borrelien-Suchtests (IFT, ELISA
etc.) und ein Borrelien-Bestätigungstests
(rekombinanter Bb-Westernblot)
durchgeführt werden, sondern alle möglichen
Testvarianten versucht werden wie z.B: Bb.-PCR,
LTT-Borrelien, Bb.-Elispot, NK-Zell-Bestimmung, Direktnachweis,
CXCL 13-Wert-Bestimmung, ACGal-Reaktion und HLA-Fein-Typisierung.
Patienten mit nachweisbarer Borreliose [PCR
u./o. Kultur] die aber keine
spezifischen Borrelienantikörper bilden, verbergen sich
hinter folgender genetischen Prädisposition [98]:
HLA-DRB1*0101, *0102, *0104 u. *0105.
Ich kann dbzgl. Nur Mut machen, siehe nachfolgende Ausführungen
zum Thema MS-Diagnose kritisch hinterfragen.
|
|
|
|
|
|
|
|
|
|
|
|
Als
weiteres möchte ich am Anfang meiner Themenseite Multiple
Sklerose und Neuro-Borreliose einen ärztlichen Befund
vorstellen, der veranschaulichen mag das immer eine kritische
Hinterfragung von seiten das Patienten geschehen sollte, sofern
z.B. die Diagnose Multiple Sklerose (MS) gestellt
wird/wurde. Dies ist ein Befund von vielen, der als
Beispiel veranschaulichen mag das die Syndrom-Diagnose Multiple
Sklerose sicherlich nicht einfach vom Patienten angenommen werden
sollte, sofern nicht alles versucht wurde um eine Borreliose oder
eine andere bakteriologische Erkrankung auszuschließen.
|
|
|
|
|
|
Die
“Fachleute“ vom Nationalen-Reverenz-Zentrum Borrelien
(NRZ-Borrelien) würden
sicherlich wieder nur von “einen Fallbeispiel“ sprechen,
einer Ausnahme die keinen Wert in Bezug auf andere Multiple
Sklerose Fälle hat. Ich bin hier aber anderer Meinung,
ich könnte an dieser Stelle schon mehrere Fälle
nennen, denen es ähnlich ging, wie der Patientin dessen
Befund ich nachstehend als Beispiel zeigen möchte.
|
|
|
|
|
|
Der
Befund wurde mir freundlicherweise von einer der Patientinnen für
meine Homepage per e-mail zugesendet und zum veröffentlichen
freigegeben, um zu zeigen, dass es niemals zu spät ist eine
anständige und ursächliche Diagnose zu erhalten. Nur so
kann eine durchgreifende Therapie erfolgen, z.B. eine hochdosierte
Langzeit Antibiotikum Kombi-Therapie. Man kann nur sagen, ein
Segen hat die Patientin eine entzündungshemmende Behandlung
(z.B. mit Kortison) während
ihrer langen Leidenszeit immer abgelehnt. So eine Behandlung wäre
im Fall der chronischen Borreliose sicherlich fatal gewesen. In
der ersten Zeit hätten Entzündungshemmer sicherlich
Linderung gebracht, im späteren Verlauf der Erkrankung aber
hätten sie wahrscheinlich zu einen schnelleren und
aggressivieren Verlauf geführt. Auch hätte eine
entzündungshemmende Behandlung wahrscheinlich das Immunsystem
so unterdrückt, das zur Zeit (2008)
der durchgeführten Labodiagnostik eventuell keine als
Borrelien-spezifisch geltende nachweisbare Reaktion mehr
stattgefunden hätte.
|
|
|
|
|
|
Zur
25jährigen Leidens- u. Krankengeschichte (Anamnese)
der Patientin:
|
|
|
|
|
|
Die
Patientin hatte als 18jährige (1983)
in Schottland eine festsitzende Zecke bemerkt, zu dessen
Entfernung sie dort in eine Krankenhaus ging wo man ihr sagte das
eine Zecke dort keine Gefahr darstellt. Doch in der Folge machte
die Patientin eine lange Krankengeschichte mit zahlreichen Arzt-
und Klinkbesuchen durch. Eine wahre Odyssee, ohne wirkliche
Diagnose, außer z.B die Syndrom-Diagnose Multiple Sklerose -
muss wohl als eine Verlegenheitsdiagnose der Fachärzte
gewertet werden. Keiner der Fachärzte nahm sie bis zur
Stellung der Diagnose am 07.07.2008 wirklich ernst, man hatte Ihr
sogar schon eine psychologisches Gutachten erstellt, in denen man
vorschlug sie stationär in eine Psychiatrie aufzunehmen. Für
das Selbstwertgefühl eines chronisch Kranken natürlich
das Beste was passieren kann, wenn man die Diagnose eines
“Dachschadens“ erhält - in meinen Augen
verantwortungslos so leichtfertig solch eine Diagnose zu stellen.
Die ohnehin schon vorhandenen Depressionen der Patientin (siehe
auch Seite: Symptome, Punkt [23] Systemische Entzündung),
wurden durch diese Diagnose sicherlich noch verstärkt. Die
Psychologen hielt alles nur für eine psychosomatische
Störung, die Patientin bilde sich ihre Erkrankung nur ein.
Ich kann nur sagen, tolle Fachärzte die so eine
schwerwiegende Diagnose stellen ohne wirklich alles zu tun um eine
ursächliche Erkrankung (z.B. in diesem
Fall Borreliose) auszuschließen oder diese zu
bestätigen. Auch zwei Fehlgeburten führten zu keiner
intensiven Ursachensuche (siehe hierzu:
Merkblatt, Tarnstrategien, CB1 Rezeptor / fbr-Protein). In
der Folge bekam sie immer mehr Beschwerden, u.a. auch eine
Multiple-Chemikalien-Sensitivität (MSC)
die sich z.B. als Allergie auf bestimmte Chemikalien und Gerüche
äußert. Die Multiple-Chemikalien-Sensitivität
(MCS) machte es nötig, das ihr
Haus in dem sie wohnt für etliche 10.000 EUR zu sanieren. Sie
suchte daher auch bei Selbsthilfegruppen Gehör, so z.B. bei
anderen MCSlern (www.csn-deutschland.de)
und in wie sie sagte, ihrem Behindertenclub (www.dgmcs.de).
Warum? Um mit ebenso betroffenen Menschen zu sprechen, da sie
sonst kaum noch jemand - bzgl. ihrer Erkrankung - ernst nahm. Wie
denn auch, wenn man die Diagnose “Dachschaden“ bekommen
hat. In den letzten 6 Jahren hatte sie, weil sie nicht mehr
arbeitsfähig war, ein Rechtsverfahren auf Frühverrentung
laufen. Das aber auch nicht so recht voran kam, da keine wirkliche
Diagnose vorlag. Doch jetzt der Befund der ihr Leben seither
verändert hat, sie kann wieder optimistisch in die Zukunft
blicken und es besteht Aussicht auf Heilung.
|
|
|
|
|
|
|
|
|
|
|
|

Quelle:
Befund einer Patientin die anonym bleiben möchte
|
|
|
|
|
|

Quelle:
Befund einer Patientin die anonym bleiben möchte
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Einleitung zur
Seite mit dem Themenschwerpunkt Multiple Sklerose (MS /
MS-Syndrom):
|
|
|
|
|
|
>>
Unter den Medizinern auch Encephalomylitis Disseminata
(ED) genannt <<
|
|
|
|
|
|
Ich
möchte mit dieser MS-Themenseite nur die bekannte Fakten in
Bezug auf das MS-Syndrom betrachten und die einzelne Puzzelteile
zu einem möglichen Gesamtbild zusammenfügen. Inwieweit
mir das gelungen ist, wird vielleicht die Zukunft der MS-Forschung
zeigen. Auch möchte ich mit dieser paramedizinischen [A]
Seite nicht die bisherigen Erkenntnisse der Schulmedizin in Abrede
stellen, noch in der Gesamtheit in Frage stellen. Es gilt
allgemein als unumstritten das es sich beim MS-Syndrom um ein
Paradebeispiel einer vermutlich multifaktorellen
Entmarkungskrankheit handelt, bei der in erster Linie die
Markscheiden (Isolierungen der Nervenbahnen,
Energieversorger der Verven und Taktgeber) von der
Immunabwehr angegriffen werden und die Neuronen (Nervenzelle)
und Axone (Nervenzellausstülpungen,
Leitbahnen) weniger von Beschädigungen betroffen sind.
Aus vorgenannten Grund spricht man i.d.R. unter Schulmedizinern
auch von einer primären entzündlichen Myelinkrankheit.
Aber schon bei diesem Punkt scheint man sich in den
unterschiedlichen Lagern der Schulmedizin nicht ganz einig zu
sein, da man von einer primären Myelinkrankheit eigentlich
nur dann spricht, wenn die Axone nicht betroffen sind [40].
Von sekundären Myelinkrankheiten spricht man hingegen wenn
der Myelinschwund die Folge axonaler, vaskulärer oder einer
anderen Schädigung sind. So heißt es z.B. in
entsprechender MS-Literatur auch, entscheidend sind vielmehr die
irreversiblen neuronalen-axonalen Schäden die im bildgebenden
Verfahren des MRT [N] als
permanente “schwarze Löcher“ (black
holes) erscheinen [24].
Oder: die frühsten krankhaften Erscheinungen sind nicht an
den Nerven- und Gliazellen zu finden, sondern in und an den
Blutgefäßen [41].
Hierzu passt auch, die MS ist das klassische Bild einer
chronischen Entzündung, die von der Umgebung der Venolen
(Gefäße) aus in die
Markscheiden vordringt [40] (siehe
auch Seite: Symptome, Punkt [23] systemische Entzündung).
Soweit vorab zu den doch recht unterschiedlich anmutenden
Meinungsbild der Schulmedizin zum Symptomkomplex Multiple
Sklerose.
|
|
|
|
|
|
In
der Sache das es sich bei der Multiple Sklerose (MS)
um eine erworbene, entzündliche, primäre Erkrankung
des Myelins handelt, muss somit wohl schon vorab auf meiner Seite
in Frage gestellt werden. Eventuell ist der Myelinschwund nur
die sekundäre Folge, einer übergreifenden, primären
Gefäßerkrankung oder andersartigen organischen
unterschwellig verlaufenden Erkrankung(en) die sich zum bekannten
MS-Symptombild ausbildet. Dann müsste man aber von einer
sekundären Myelinkrankheit sprechen - oder werden einfach zu
viele Erkrankungen unter der Nomenklatur Multiple Sklerose
(MS) zusammengefasst?
|
|
|
|
|
|
Da
man bei der klinischen MS-Forschung in eine Sackgasse geraten
war/ist, hat man sich seit 2001 zum sog. “Data Mining“
entschlossen [86]. Hierunter versteht
man aus gesammelten digitalen Datenbanken, entsprechende
Informationen herauszufiltern um Merkmal-Profile zu erstellen. Mit
anderen Worten, man betreibt eine digitale Datenanalyse. Hierzu
werden in München, am “Sylvia Lawry Centre for Multipler
Sklerose“, Daten von MS-Patienten aus der ganzen Welt
gesammelt. Das erfreuliche an der Sache, eine Großzahl der
Pharmazieunternehmen hat sich vertraglich verpflichtet auch ihre
Patientendaten zur Verfügung zu stellen.
|
|
|
|
|
|
Bei
neueren Studien konnte gezeigt werden, dass beim MS-Syndrom die
autoimmune Reaktion nicht initial durch Myelinschäden an den
Nerven ausgelöst werden, sonder diese vielmehr durch einen
fehlgeleiteten Angriff der Immunabwehr erst entstehen (Stand
2012 [111]).
|
|
|
|
|
|
Allerdings
genügt sehr wahrscheinlich nicht alleine eine
fehlgeleitete Immunabwehr, sondern es kommt ein MS-spezifischer
Gen-Defekt hinzu. Diese Genvariante (Gen-Defekt
?) macht die Andockstelle des Tumornekrosefaktors
(TNF) löslich, wodurch in
Folge dieses wichtige Signalmolekül blockiert wird und es zu
den typischen Entzündungsherden kommt [112].
Diese genvariante (Gen-Defekt?) kommt
zwar auch bei gesunden Personen vor, was aber nur einen Hinweis
gibt das die kurze TNF-Variante alleine nicht krank macht, sondern
vielmehr mindestens ein zweiter Faktor hinzu kommen muss (z.B.
Infektionserkrankung die zur chronischen Entzündung führt).
Das MS-Syndrom ist somit keine rein genetische Erkrankung,
sondern vielmehr sorgt die kurze TNF-Genvariante für eine
Empfänglichkeit dbzgl. (sogen.
Prädisposition). Tritt Faktor 2 nicht ein (z.B.
Borreliose), dann kommt es auch zu keiner
MS-Syndrom-Erkrankung. Faktor 2 alleine führt allerdings auch
nicht zur persistierenden bzw. chronischen Syndrom einer MS, beide
Faktoren zusammen führen erst zum MS-Syndrom.
|
|
|
|
|
|
Im weiteren Verlauf
dieser Seite möchte ich nicht in allen Einzelheiten und
allumfassend auf das MS-Syndrom (Multiple
Sklerose) eingehen, nur soweit wie es zum Verständnis
wichtig ist. Hierzu gehören natürlich auch kurze
Erläuterungen zur Gliederung und dem Aufbau der vom
MS-Syndrom betroffenen Körperbereiche (Organe;
Gehirn / ZNS, Nervenbahnen / PNS etc.), weil man sonst
nicht die Zusammenhänge und möglichen Auswirkungen
versteht. Auch möchte ich die doch recht vagen Kriterien der
MS-Diagnostik aufzeigen, die in mein Augen sehr viel dürftiger
sind, als eine ungenügend gesicherte serologische
(Lyme)-Borreliose / low-dose-borreliosis. Hier sind wir auch
bei dem Punkt angelangt, warum ich von MS-Syndrom spreche und
nicht von MS-Erkrankung. Da unter der Nomenklatur
Multiple Sklerose (MS)
vier bis fünf verschiedene Verlaufsformen (siehe
Abb.: Verlaufsformen der MS) zusammengefasst werden,
deren einzelne Auslöser (Ursachen
z.B. Krankheitskeim/e: Viren, Bakterien) man noch nicht
mit letztendlicher Sicherheit kennt oder als zu ungenügend
abgesichert einstuft.
|
|
|
|
|
|
|
|
|
|
|
|
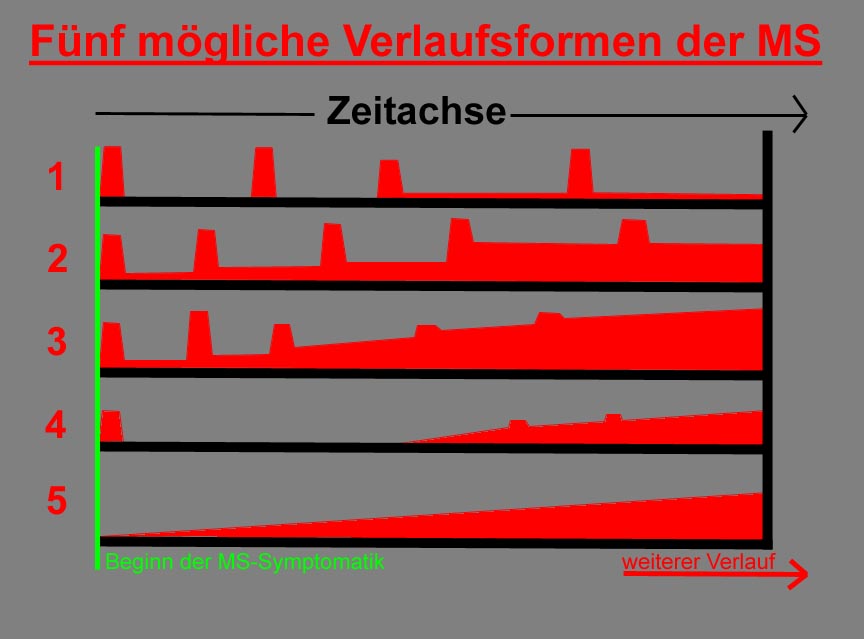
Quelle,
modifiziert gez. von A. Hartwig nach: Rüttinger, H. (1994):
Multiple Sklerose - Informationen und Ratschläge, Verl. Piper
München - Chapman & Hall Weinheim, S. 20, ISBN
3-492-11936-0
|
|
|
|
|
|
Modellvorstellungen
der unterschiedlichen MS-Verlaufsformen nach A. Hartwig:
|
|
|
|
|
|
1.- MS-Form:
Die ersten Schübe (Grafik 2 Schübe)
werden durch das Andocken der Borrelien (Bb.sl.-Komplex)
an den entsprechenden Nerven (Affinität
= molekulare Bindung)
und den unspezifischen Entzündungsreaktionen hierauf
verursacht, durch dauerhafte Anwesenheit (Persistenz)
der Borrelien kommt es zur chronischen unspezifischen Entzündung
die sich in den Vermehrungsphasen der Borrelien verschlimmert
(Grafik ab Schub 3). Durch eventuelle
frühzeitige entzündungshemmende Behandlungen
(z.B.Kortison), bleiben spezifische
Borrelien-Antikörper aus. Eventuelle serologische Zeichen:
oligoklonale Bande, Bb.-kD-Bande 41, 62
kD (58-62 kD) und 67 kD (66-68
kD), später vermutlich eine Sorte der autoreaktiven
Antikörper GM1,
GD1b u./o. GT1b durch schwache bzw.
einfache Prädisposition (erbliche
Empfänglichkeit).
|
|
|
|
|
|
2.- MS-Form:
Die ersten Schübe werden wieder wie unter Punkt 1
beschrieben, durch die unspezifischen Entzündungen verursacht
(Anheften der Borrelien / Affinität).
Paralell werden entsprechende autoimmune Immunzellen (sog.
Bystander) aktiv und es bilden sich sofort autoreaktive Antikörper
(GM1,
GD1b u./o. GT1b)
durch mehrfache bzw. starke Prädisposition (erbliche
Empfänglichkeit).
|
|
|
|
|
|
3.- MS-Form:
Durch eine Bestehende, mit Borrelien kreuzreaktive Grundinfektion
(anderes slow-virus) ist das
Immunsystem schon in gewisser Weise autoimmun ausgerichtet, hält
sich aber die Waage mit dem Grundinfektions-Krankheitskeim
(Antigen u. Antikörper Gleichgicht)
– krankhafte (pathogene)
Reaktion gegen Selbst sind deswegen sehr gering ausgeprägt,
so dass sie bis dahin nicht oder nur schwach wahrgenommen werden
(z.B. vereinzelt Ameisenlaufen,
Elektrisiergefühl, Kribbeln, häufiges Gefühl
eingeschlafene Hände u./o. Füße zu haben usw.).
Mit der zusätzlichen Borrelieninfektion gerät das
ausgewogene Antigen-Antikörper-Gleichgewicht aus den Fugen,
da die Borrelien in ihren phasenweise Vermehrungszyklen verstärkt
das Immunsystem aktivieren. Folge: die MS nimmt einen schnellen
und starken Verlauf mit rascher Blut-Hirn-Schrankenstörung,
verstärkte Aktivierung autoreaktiven Immunzellen,
Autoantikörperbildung usw.
|
|
|
|
|
|
4.- MS-Form:
Es kommt vorerst nur zu einen Schub nach der Borrelieninfektion,
verursacht durch das Anheften (Affinität)
der Borrelien an die Nerven. Bedingt durch eine schwächere
Initial-Infektion bleiben vorerst weitere Schübe aus, nach
geraumer Zeit kommt es durch die Genregulierung (z.B.
die Gene ICAM-1, MIP-2a etc.)
der Borrelien zur Unterdrückung bzw. Ausbleiben bestimmter
Immunabwehrreaktionen (z.B. CD57+
Zellen). Folge: ein bis zu diesem Zeitpunkt durch
die Immunabwehr in Schach gehaltenes kreuzreaktives slow virus
(schleichende o. latente Co-Infektion, z.B.
EBV, Masern, Röteln etc.), welches sich bis dahin
“schlafend“ (latent) im
Körper befand, kann sich nun verstärkt zusammen mit den
Borrelien vermehren und führt zum chronischen Verlauf der MS.
Da die Borrelien einen Immundefekt bewirken, müssen sie aber
- primär - als die eigentlich auslösenden Erreger
betrachtet werden.
|
|
|
|
|
|
5.- MS-Form:
Die MS ist durch ein anders slow-virus oder toxische bzw.
entzündungsverursachende Stoffe (z.B.
Amalgamfüllungen; Quecksilber oder andere neurotoxische
Stoffe) verursacht, nicht durch Borrelien. Ausbrechen der
Erkrankung eventuell durch hormonelle Veränderungen,
psychische Belastung (Dis-Stress),
Infekt (z.B. Grippe), Impfen,
Drogenmissbrauch usw.
|
|
|
|
|
|
|
|
|
|
|
|
Unter Syndrom
versteht man in der angewandten Schulmedizin
durch bestimmte Symptome oder einem Symptomenkomplex
gekennzeichnete Krankheitsbilder, meist von noch nicht bekannter
oder allgemein anerkannter Ursache. Da dieses
Einordnungskriterium bei der Multiple Sklerose (MS) zutrifft,
spreche ich von MS-Syndrom und nicht von Erkrankung.
(An)-Erkennt man den auslösenden Krankheitskeim oder ordnet
man diesen eine der MS-artigen Nervenerkrankung zu, dann würde
ich z.B. von EBV, Chlamydien oder durch Borrelien bedingter
Multiple Sklerose sprechen (z.B.
autoreaktive MS-Borreliose).
|
|
|
|
|
|
So heißt es z.B.
schon 1995 in puncto Borrelien wie folgt: Borrelia burgdorferi
weist minimal 12 verschiedene Hitze-Schock-Proteine (HSPs)
auf. Wenn einer der folgenden kD-Bande auftaucht, 28- (p28),
45 (p45) u./o. 66-kD (p66)
lösen sie vermutlich HSP-Antikörper aus (z.B.
anti-p66-AK etc.). Die HSPs sind aber nicht immer über
Antikörper feststellbar. Die HSPs sind weniger spezifisch als
die Borrelien-lipoproteine, schließen aber trotzdem keine
durch sie verursachte Krankheitssymptome aus. Wenn die HSPs
zusammen mit Lyme-neurologischen Problemen erscheinen, ist ein
MS-Syndrom zu erwarten [42].
|
|
|
|
|
|
Bemerkenswert
erschien es den Wissenschaftlern bei einer weiteren
Studie (Tierversuch mit Affen) zu den
Borrelien-bedingten (in diesem Fall Bb.ss.)
kD-Banden, das i.d.R. nur eine der als diagnostisch geltenden
kD-Banden auftrat. Sie folgerten daraus: Die Affen,
wären sie Menschen gewesen, wären alle als
unbestätigte Lyme-Borreliose eingestuft worden [43].
|
|
|
|
|
|
Experimentelle
Untersuchungen weisen auch auf einen Zusammenhang hin das
T-Zell-Klone (Th1-polarisierte CD4+
Lymphocyten) durch einer Borrelien-Infektion aktivierte
werden können, die sowohl mit Borrelien-Antigenen als auch
mit dem sogen. HSP 90 (Hitzeschock-Protein)
reagieren können. Dies wäre ein weiterer Indizes
dafür, dass eine Borrelieninfektion eventuell zu einer
Autoimmun-Erkrankung führen kann [100/101/108/109/
110]. Allerdings muss diese These noch durch weitere
Studien bestätigt werden (Stand 2009).
Bewahrheitet sich beim HSP 90 eine autoimmune Beeinflussung
durch Borrelien, könnte hier, neben der Primärreaktion
der Autoimmunität, als sekundäre Erscheinung
schwerwiegende epigenetische Beeinflussungen beim Patienten
(z.B. Entartung von Zellverbänden)
auftreten. Beim HSP 90 handelt es sich um ein
sogenanntes Chaperon-Protein [103] (zu
Deutsch Anstandsdame), was andere Proteinmoleküle
unterstützt ihre korrekte räumliche Struktur zu bilden
und zu bewahren. Verlieren nun andere Proteine ihre
biologische funktionelle Struktur, dann formen die
Chaperon-Proteine (z.B. HSP 90) diese
denaturierten Proteine wieder neu, so das sie ihrer funktionellen
Aufgabe wieder nachkommen können. Das HSP 90 ist insbes.
auf die Bildung und Erhaltung von Signal-Proteine spezialisiert,
die für ein funktionierende Kommunikation in und zwischen den
Zellen verantwortlich sind. Das HSP 90 ist somit am
Kommunikations-Geschehen beteiligt, welches für die
Regulation von Zellzyklus und der Entwicklung von Zellverbänden
elementare Bedeutung hat. Wird das Chaperon HSP 90 in seiner
Funktion gehindert, z.B. durch autoreaktive Immun-Reaktionen, ist
ein Organismus (bzw. betroffenes Organ,
Zellverband etc.) auf Dauer nicht lebensfähig. Bei
einer verringerten HSP 90-Konzentration kommen gehäuft
Mutationen vor [102].
|
|
|
|
|
|
Soweit am Anfang
meiner Seite über den möglichen Zusammenhang MS-Syndrom
und Borreliose. Ich hoffe damit habe ich genügend Interesse
geweckt diese Seite weiter zu lesen, um mehr über die von mir
vertreten MS-Entstehungstheorie zu erfahren.
|
|
|
|
|
|
Jede der fünf
MS-Verlaufsformen hat wahrscheinlich eine andere Ursache. Ich
würde keines Falls Borrelien allein für alle
Verlaufsformen verantwortlich machen, den universellen Verursacher
für das MS-Syndrom gibt es nach heutiger Erkenntnis mit
ziemlicher Sicherheit nicht. Ich Stufe die Multiple Sklerose
deswegen auch als MCR-Syndrom (Multiple-Causal-Result-Syndrom)
ein, sprich, als einen sekundären
Nervenerkrankungs-Symptomkomplex mit vielen verschiedenen
möglichen Ursachen u./o. Risikofaktoren.
|
|
|
|
|
|
Von Multiple
Sklerose (MS)
wird heute gesprochen, wenn man die entsprechende Ursache
(toxische Stoffe, Viren, Bakterien etc.)
der Nerven-Entzündungen nicht ausfindig machen kann
oder will ? - frei nach dem Motto: Wir sparen bei der Diagnostik,
koste es – in der Zukunft – was es wolle.
|
|
|
|
|
|
Bei einer
autoreaktiven Borreliose, sofern sie als solche vom behandelnden
Arzt - rechtzeitig - erkannt wird, wird man nicht mehr von MS
sprechen. Aber leider werden wohl viele Fälle der
autoreaktiven Borreliose-Erkrankungen auch heute noch als MS
diagnostiziert, da viel zu wenig auf die einzelnen Zeichen und
Symptome der Borreliose geachtet wird oder diese als zu ungenügend
sicher für eine durchgreifende Antibiose (>
vier Wochen, siehe z.B. unten Chlamydienbehandlung)
eingestuft werden. So schätzen viele Ärzte eine
fehlgeschlagene Antibiose als weiteres sicheres
Bestätigung-Zeichen der MS-Diagnostik ein, obwohl inzwischen
bekannt ist, das die Borrelien (z.B. L-Form
Borrelien) oder auch die Chlamydien häufig sehr schwer
mittels Antibiotikum erreichbar sind.
|
|
|
|
|
|
Letztendlich ist es
wohl noch eine Glaubensfrage - behandelt man eine
Borrelieninfektion frühzeitig, wird man wohl das Stadium der
MS-Symptome (³
2. Borreliose-Stadium) mit großer
Wahrscheinlichkeit vermeiden und jeglichen Zusammenhang übersehen
(siehe
unten Abs.: Prävalenzdaten MS/Bb.).
Behandelt man eine vermeintliche ungenügend abgesicherte
Borreliose nicht, so kann sie eventuell in den autoreaktiven
Zustand übergehen und ein MS-Syndrom “vortäuschen“.
In diesem “vorgetäuschten“ MS-Stadium ist die
Diagnose der Lyme-Borreliose dann wiederum schwer, da die bei
dieser Form der Borreliose auftretenden serologischen Marker
(Antikörper, HSP-kD-Bande, oligoklonale
Bande etc.) häufig nicht als sichere standardisierte
Borrelien-Zeichen eingestuft werden. Vielmehr gelten einige dieser
serologischen Marker langläufig noch als Bestätigung,
allein für die Multiple Sklerose. So schließt sich der
Teufelskreis, was die ganze Sache zur Glaubensfrage macht. Meiner
Meinung nach sind einige MS-Fälle das autoreaktive Ergebnis
der Neuro-Borreliose (vorrangig Bb.
Geno-Typ 2), sowie die Lyme-Borreliose (vorrangig
Bb. Geno-Typ 1) im Endstadium (Stadium
3) eine schwer serologisch zu diagnostizierende
sogenannte therapieresistente erosive Arthritis verursachen kann.
So wie nicht jeder Arthritisfall Borrelien-bedingt ist, so wird
auch nicht jeder MS-Fall seine Ursache in einer Borrelieninfektion
haben. Doch spricht die Häufigkeit (ca.
£ 30 v. 100.000 Einwohner
= Prävalenzrate) des MS-Syndroms für eine sehr
gegenwärtige Ursache. Borrelien stellen allemal bei ca.
50.000 Neuinfektionen pro Jahr ein allgegegenwärtiges Problem
dar. Mag sich ein jeder selbst, anhand der folgenden
Ausführungen (Fakten), ein Bild von der schwierigen Sachlage
machen.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Was bezeichnet
man als Multiple Sklerose (Encephalomylitis Disseminata):
|
|
|
|
|
|
Was versteht man
unter dem Syndrom das der Volksmund als Multiple
Sklerose (MS) und die Mediziner heute als
Encephalomyelitis disseminata (ED)
bezeichnen?. Das Wesentliche besagen schon die allgemein üblichen
Bezeichnungen Multiple (vielfache)
Sklerose (Verhärtung) o.
Encephalo- (Encephalon = Gehirn)
myelitis- (= Rücken-marksentzündung)
disseminata (= verstreut) über
das Syndrom aus.
|
|
|
|
|
|
Die Bezeichnung
Multiple Sklerose ist die Ältere der Beiden, sie wurde im
vorletzten Jahrhundert von den Ärzten geprägt, die
jene prägnanten Auswirkungen am Gehirn (Encephalon)
und Rückenmark (Myelon)
erstmals beobachteten bzw. beschrieben. Da es damals
noch keine bildgebenden Untersuchungsverfahren wie
Magnet-Resonanz-Tomographie (kurz: MRT
[N]) gab,
konnten die Mediziner die Auswirkungen bzw. das sichtbare
Endergebnis nur am verstorbenen Patienten (pathologisch)
untersuchen. Bei den pathologischen Untersuchungen fielen den
Ärzten (Pathologen) die
vielen (multiple)
charakteristischen verhärteten (sklerotischen)
Stellen in der weißen Substanz des
Zentralnervensystem (kurz: ZNS
= Gehirn- u. Rückenmark) auf, die das Ergebnis des
körpereigenen Reparaturmechanismus sind. Bei den
Verhärtungen handelt es sich um ehemalige Entzündungsherde,
bei denen vermehrt Bindegewebe eingelagert wurde. Hierbei handelt
es sich im Prinzip um eine fehlgeschlagene oder um die
bestmögliche Reparatur unter den gegebenen Bedingungen, die
der Körper den Entzündungsschäden entgegen zu
setzen hat. Die Verhärtungen werden auch
Gliasklerose genannt, da sie i.d.R. aus faserbildenden
Gliazellen (siehe Abb. und Abs.: Nerven)
gebildet werden. Die Gliasklerosen (Glianarben)
sind wallartige Gebilde, die sich an den durch
Entzündungen beschädigten Nervenbahnen (=
Neuriten: Axon u. Hüllzellen), bzw. an deren
Markscheiden (= Hüll- o. Mantelzellen /
Gliazellen) bilden (Entstehung
Gliasklerosen siehe unten Kap.: Aufbau der Nerven des ZNS und PNS,
Abs.: Mikroglia-Zellen).
|
|
|
|
|
|
|
|
|
|
|
|
Wer sich schon
eingehend mit seiner Erkrankung (MS o. NB),
bzw. mit den Nerven, Gehirn und Rückenmark auseinander
gesetzt hat, kann die drei nachfolgenden Kapitel überspringen.
Wer schon weiß wo Oligodendrozyten, Schwansche-Zellen oder
sogenannte Gliazellen vorkommen, was Axone und Markscheiden sind,
der wird in den folgenden Kapiteln - wahrscheinlich - nichts neues
für sich entdecken. Die drei Kapitel sollen nur ein kleiner
Schnellkurs in puncto Nervensystem (ZNS/PNS)
sein, damit die unten aufgeführten Immunmechanismen und ihre
zerstörerischen auroreaktiven Angriffspunkte besser
verstanden werden. Das ein jeder verstehen kann, wo und warum es
zu Entzündungen im Nervensystem kommt (siehe
auch Seite: Modellvorstellung Borrelieninfektion – Mimikry /
Immunopathie).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nervensystem
(NS) - Gehirn, Rückenmark (ZNS) u. die peripheren
Nervenbahnen (PNS):
|
|
|
|
|
|
Das ZNS
(Zentral
Nerven System = Gehirn u. Rückenmark)
besteht aus grauer und weißer Substanz. Die
graue Substanz (Zellkörper der
Nerven) kann am
Gehirn mit bloßem Auge von der weißen
Substanz (Nervenleitungs-bahnen mit
Isolierung) unterschieden werden, da sie i.d.R.
scharf von der weißen Substanz abgegrenzt ist. Die helle
Farbe der weißen Substanz rührt von der fettähnlichen
Masse (Mark-, Myelin etc. - siehe unten)
her, die sich als Isolierung um den Nervenfasern (Axon,
Neurit etc.) befindet. An einer Stelle (Formation
reticularis) im Hirnstamm (Truneus
cerebri) ist die Unterscheidung nicht ganz
so offensichtlich, da dort die graue und weiße
Substanz netzartig verflochten ist. Der Hirnstamm
ist die Verbindungsstelle (Schaltstelle)
zwischen dem Gehirn (Encephalon)
und dem Rückenmark (Medulla
Spinalis). Außerhalb vom ZNS bilden einige
Nervenzellen Ansammlungen die als knotenförmige
Anschwellungen an den Nervenbahnen sichtbar sind, sogenannte
Ganglien. Deswegen werden die Nervenzellen einer solchen
Ansammlung (sogen. Ganglion) auch
Ganglienzellen genannt.
|
|
|
|
|
|
Das Gehirn
(= Encephalon) wird durch eine
dreilagige Membran (Meninges,
Gehirnhäute) geschützt. Die äußere
“harte Hirnhaut“ wird “Duramater“, die
mittlere lockere “Spinnwebhaut“ “Arachnoidea“
und die innere dünne “weiche Hirnhaut“ “Pia
mater“ genannt. Im Bereich des Rückenmarks setzen
sich diese Häute fort, nur das dort die äußere
harte Haut (Duramater) durch
relativ lockeres Bindegewebe, welches von vielen Blut-Gefäßen
durchzogen wird, vom Knochen getrennt ist.
|
|
|
|
|
|
In der
Kopfregion wird das Zentrale Nervensystem / ZNS
von 12 verschiedenen Hirnnerven (Nervenpaaren;
sogen. Nervi craniales) verlassen, die z.B. direkt zu den
Augen, Zähnen etc. führen. Im Wirbelsäulenbereich
entspringen dem Rückenmark (Medulla
Spinalis) 31 Nervenpaare (sogen.
Spinalnerven), die ja nach Austrittsort
unterschieden werden und einzelnen Erfüllungsorganen
(z.B. Lunge, Herz, Leber usw.)
zugeordnet werden können.
|
|
|
|
|
|
Das Rückenmark
baut sich, wie oben schon erwähnt, aus sogenannter
weißer und grauer Substanz auf. Die weiße
Substanz (Außen-Zylinder)
wird vorallem aus den isolierenden Myelinhüllen
gebildet, welche die Nervenfasern umgeben. Man spricht
bei den Hüllen auch vom Neurolemm, Neuroglia,
Gliazellen oder Nervenstützgewebe. Im PNS (peripheres
Nerven-System) spricht man
hingegen von Nerven-Scheiden oder Ganglien-, Hüll-, Mantel-
oder sogenannten Schwannschen-Zellen.
|
|
|
|
|
|
Das Stützgewebe
dient selbst nicht der Weiterleitung von Nervenimpulsen, sonder
vielmehr der Isolierung, dem Schutz vor Keimen (z.B.
Bakterien) und der Versorgung der eigentlichen
Nervenleitbahnen (Neuronen, Axone) -
so die langjährige Meinung der Neuro-Wissenschaftler in den
vergangenen Jahrzehnten. Heute (Stand 2008)
hat man in diesem Punkt allerdings hinzugelernt und nach neuem
neurologischen Verständnis haben die Neuro-Gliazellen
durchaus eine weitere wichtige Funktion inne, sie sind
quasi die Taktgeber und Synchronisatoren der Nervenzellen und
Synapsen [94].
Man muss sich dies ähnlich wie in einem PC (Personal
Computer) vorstellen. Dort werden Informationen bzw.
Impulse (im ZNS gleichzusetzen mit
Nervenreize) in Form von Einsen und Nullen (Ja/Nein),
die digitale Ebene, auch in der physikalischen Ebene der
Transistoren (im ZNS gleichzusetzen mit
Neuronen u. Synapsen) mittels Durchlassen oder Sperren
verarbeitet. Damit dieses im PC funktioniert bedarf es allerdings
noch einer weiteren Steuerung, der Synchronisation der
Transistoren, welche der Prozessor (im ZNS
gleichzusetzen mit den Gliazellen, Astrozyten) z.B. in der
Taktfrequenz von 2-Gigahertz-Impulsen übernimmt. Je schneller
die Taktfrequenz, um so schneller geschieht die digitale
Datenverarbeitung der Einsen und Nullen in den Transistoren. Ist
der Prozessor (Taktgeber bzw.
Synchronisator) im PC defekt, funktioniert die ganze
digitale Datenverarbeitung nicht. Im übertragenen Sinne auf
die Neurologie bzw. das Gehirn (ZNS)
bedeutet dies, sind die Neuro-Gliazellen beeinträchtigt
oder in ihrer Funktion gestört, funktioniert der Rest des ZNS
nicht mehr richtig weil die Nerven-Impulse außer Takt
geraten (siehe Seite: Merkblatt,
Diagnostik, gestörtes EEG bei Borreliosepatienten).
|
|
|
|
|
|
Die graue
Substanz baut sich vorrangig aus den Zelkörpern
der motorischen Neuronen und der Interneuronen auf.
Unter den motorischen Neuronen (Motoneuronen)
versteht man die Nervenleitbahnen im ZNS, welche der Kommunikation
mit den Erfüllungsorganen dienen. Als Interneuronen
(Schaltneuronen) versteht man jene
Nerven (Neuronen) die eingehende
Signale analysieren und bewerten, sie stellen circa 90 Prozent der
gesamten Neuronen im ZNS. Im Rückenmark bilden die
Interneuronen (Bewertung Impuls)
zusammen mit den sensorischen Nerven (Eingang
Impuls) und motorischen Nerven (Ausgang
Impuls) den sogen. Reflexbogen, der
i.d.R. ohne Beteiligung des Gehirns Reize
(Impulse) verarbeitet - z.B.
reflexartiges Zurückziehen der Hand von einer heißen
Herdplatte. Es gibt angeborene Reflexe (z.B.
Schlucken, Kältezittern etc.), Primitivreflexe (z.B.
Greifreflex etc.) und erlernte Reflexe (z.B.
einem Fahrzeugausweichen, Anhalten an roter Ampel).
|
|
|
|
|
|
Die graue
Substanz im Zentrum des Rückenmarks (Medulla
Spinalis) sieht im Querschnitt von der Form her aus
wie ein Schmetterling, man erkennt auf jeder Seite drei
rausragende Buckel. Die Buckel bezeichnet man je nach
Lage: Vorder-, Zwischen- oder Hinterhorn. Die Buckel bzw.
Hörner enthalten die Synapsen (=
berührungs-lose Informationsweitergabestellen) der
ein- und ausgehenden Nerven. Das Hinterhorn ist
der Eingang der sensorischen Nerven (Reiz),
das Vorderhorn der Ausgang der motorischen Nerven
(bewusster o. reflexartiger Befehl)
und das Zwischenhorn (bzw.
Zwischenzone) ist für das nicht
willentlich beeinflussbare sogenannte vegetative Nervensystem
verantwortlich (= Steuerung
lebenswichtiger Grundfunktionen: Atmung, Herzschlag usw.).
Die Zellkörper der sensorischen Nerven (Neuronen)
befinden sich direkt außerhalb am Rückenmark (siehe
nachfolgende Abb.), die Impulsleitbahnen (Axone)
reichen hingegen teilweise tief ins Rückenmark (ZNS)
hinein.
|
|
|
|
|
|
Das
Rückenmark mit weißer und grauer Substanz sowie den
Spinalnerven
|
|
|
|
|
|
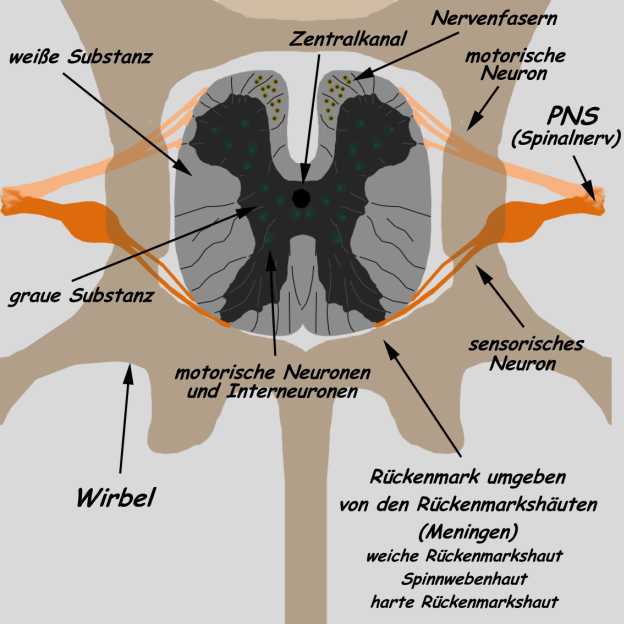
Entwurf
u. gez.: A. Hartwig
|
|
|
|
|
|
|
|
|
|
|
|
Die oben
erwähnten 31 Nervenpaare (Spinalnerven;
sensorischen u. motorischen Neuronen) splitten
sich zum Rückenmark (Medulla
Spinalis) hin in eine vordere und hintere Wurzel auf,
die wie vorab beschrieben, über das Vorder- und
Hinterhorn Kontakt zum Rückenmark aufrecht halten.
|
|
|
|
|
|
Neben dem ZNS
(Gehirn, Hirnstamm u. Rückenmark),
welches die eigentliche Schaltzentrale des Körpers ist, gibt
es noch das periphere Nervensystem / PNS.
Beim PNS handelt es sich um die Nervenbahnen die vom ZNS zu den
einzelnen Ausführungs-Organen, wie z.B. Muskeln, Haut
usw. führen.
|
|
|
|
|
|
Das PNS
kommt in allen Körperbereichen außerhalb des ZNS vor.
Das PNS setzt sich aus den sensorischen Nerven
(sensorischen Neuronen) des
bewussten Nervensystems
bzw. dem somatisches Nervensystem und dem
automatischen sowie unbewussten, dem sogenannten
vegetativen Nervensystem (siehe z.B.
oben Reflexbogen) zusammen. Das PNS bildet einen
Regelkreis, der den Körper in all seinen Funktionen im
Gleichgewicht bzw. ausgewogenen Verhältnis hält. Hierbei
handelt sich um zweier gegensinnig
(antagonistisch) arbeitenden
Systemen, die immer bestrebt sind ein dynamisches
Gleichgewicht herzustellen.
|
|
|
|
|
|
Bei den beiden
antagonistischen Systemen handelt es sich um
den sogenannten Parasympathikus und dem Sympathikus. Der
Sympathikus wird durch Anstrengung, Stress, Schmerzen,
Flüssigkeitsmangel usw. ausgelöst. Er setzt den
Körper quasi in Alarmzustand. Die Reaktionen
können sich durch Herzschlagbeschleunigung,
Blutdruckerhöhung, Pupillenerweiterung,
Darmaktivitätsverringerung, Freisetzen von
Nebennierenhormonen (Adrenalin u.
Noradrenalin) etc. bemerkbar machen. Das System des
Parasympathikus wird vorrangig in den Ruhephasen aktiv. Der
Parasympathikus veranlasst z.B. die Speicherung von Energie,
regelt die Herzfrequenz runter und regt die Drüsen und
Muskeln des Verdauungstraktes an.
|
|
|
|
|
|
Bei einer
dauerhaften (chronischen) Störung des PNS und ZNS muss
wohl mit zum Teil schwerwiegenden Symptomkomplexen
gerechnet werden, weil hierdurch der dynamische Regelkreis des
Sympathikus und Parasympathikus durcheinander geraten kann, mit
der Folge von Bluthochdruck, Darmbeschwerden (z.B. Verstopfungen)
usw.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aufbau der
Nerven des ZNS und PNS:
|
|
|
|
|
|
Nervenzellen
(Neuronen) sind i.d.R. lang und dünn aufgebaut, im ZNS
meist nur circa 1 mm und im PNS bis zu 1 m lang. Man unterscheidet
die einzelnen Nervenzellen je nach dem wo sich der Zellkörper
befindet, in multipolares, bipolares oder unipolares Neuron.
Nervenzellen bzw. Neuronen sind meist dreigeteilt aufgebaut:
Zellkörper, Dendriten und Axon (Neurit).
|
|
|
|
|
|
Der dickste Teil
der Nervenzelle (Neuron)
wird Zellkörper genannt und birgt
verschiedene sogenannte Organellen sowie den Zellkern. Der
Zellkörper wird auch Soma genannt und ist im Prinzip
das Kraftwerk und Steuerungszentrale der Nervenzelle (Neuron),
für uns, für die Fragestellung der MS oder NB
weniger von Interesse.
|
|
|
|
|
|
Bei den
Dendriten handelt es sich um meist kurze, baumartig verzweigte
Fortsätze des Zellkörpers. Sie sind quasi die
Antennen, bzw. Dateneingänge der Nervenzellen. Sie
erhalten von anderen Nervenzellen-Axonen, über deren
sogenannte Endknöpfe (sogen.
präsynaptische Endknöpfe), ihre Information. Bei
den Endknöpfen handelt es sich um Kontaktstellen, die
berührungslos mittels sogenannter Überzträgersubstanzen
(Neurotransmitter), den Datenimpuls
weiterreichen. Die Dendriten sind nach derzeitiger Kenntnis bei
der Entstehung und Ausrichtung der Entzündungen bei MS und NB
eben so wenig von Bedeutung, wie der Zellkörper.
|
|
|
|
|
|
Die längliche
faserartige
Ausstülpung der Nervenzelle wird als Axon,
Neurit, Achsenfaden,
Achsenzylinder, Nervenfaser oder Nervenfaserfortsatz bezeichnet.
Sind die Ausstülpungen eher kurz, werden sie i.d.R. Axon
genannt, sind sie lang, werden sie meist als Neurit bezeichnet -
Neuriten können meterlang sein. Der Axon/Neurit ist
im Prinzip der Datenausgang der Nervenzellen
(Neuronen). Axone (Neurit)
sind mit Hüllen versehen , die aus sogen.
Hüll- oder Mantelzellen gebildet werden (Markscheiden
o. Myelinscheiden). Es
wird bei ihnen auch
von Gliazellen
oder vereinzelt von sog. Satelitenzellen (i.d.
Großhirnrinde) gesprochen. Im allgemeinen werden die
flachen Hüllzellen im ZNS als Oligodentrozyten
und im PNS als sogen. Schwanschen-Zellen bezeichnet
(siehe auch oben: Rückenmark,
Neurolemm).
Die Hüllzellen (Markscheiden)
bestehen vorrangig aus einem Fett-Eiweiß-Gemisch, dem
sogen. Myelin. Myelin besteht zu ca. 70 Prozent aus Lipiden
(nicht waaserlösliche Stoffe, z.B.
Fette) und zu 30 Prozent aus Proteinen (Verbindung
aus Aminosäuren Þ
Eiweiße). Die vorrangigen Strukturproteine des
Myelins sind das basische Myelin Protein (MBP
/ engl. myelin
basic protein) und
Proteolipidprotein (PLP). Hingegen
machen das Myelin-assoziiertes Glykoprotein (MAG
= Mitglied d. Immunglobulingensuperfamilie) und
Myelindigodendrozyten-glykoproteine (MOG)
den geringeren Teil aus [40]. Die
Markscheiden bilden im gewissen Sinn die elektrische
Isolierung der Nervenbahnen, die in einem Abstand von 0,2 –
1 mm durch Schnürringe unterbrochen werden. Je dicker
und unversehrter die Isolierung (Markscheiden
o. Myelinscheiden) der eigentlichen Nervenleitbahn (=
Achsfaden, Axone) ist, um so schneller und besser
können sie die elektrischen Impulse (Daten)
weiterleiten. Nerven ohne Isolierung leiten die elektrischen
Impulse mit einer Geschwindigkeit von ca. 0,5 km/h weiter, Nerven
mit dicker Isolierung erreichen hingegen eine
Weiterleit-Geschwindigkeit von ca. 30-33 km/h. Bei beiden
zusammen, Axon und Markscheide, spricht man dann von Neurit.
|
|
|
|
|
|
Von den Axonen
(Neurit) gehen auch seitlich
und an deren Enden viele Verzweigungen ab, sie enden in
i.d.R. in sogenannten motorischen Endplatten (Endbäumchen
/ Teledendron) mit vielen Endknöpfen
(sogenannten präsynaptische Endknöpfe
/ Synapsen). Die
Endknöpfe (Synapsen) werden
manchmal auch als Überleitungsstelle oder Umschaltung
bezeichnet. Dort wird die Impulsweitergabe (Befehl)
entweder an einem Erfüllungsorgan (z.B.
Muskel) oder Dendriten einer anderen Nervenzelle
(Neuron) berührungslos,
mittels Neurotransmitter, weitergegeben. Eine Nervenzelle
(Neuron) kann außerordentlich
vielfältige Reaktionen auslösen, da die meisten
Nervenzellen (Neuronen) von mehreren
Nervenzellen Reize erhalten können und auch ihre Signale an
mehrere Nervenzellen weiterleiten können.
|
|
|
|
|
|
Damit die
Reizübertragung an den einzelnen Endknöpfen (Synapsen)
der Neuronen geordnet funktioniert, bedarf es einer
Synchronisation der einzelnen Hirnareale welche gerade die
eingehenden Reize (z.B. optische o.
akustische) verarbeiten sollen. Hierfür sind,
wie oben am Beispiel des PCs schon mal verdeutlicht, die
Prozessoren des Gehirns verantwortlich, die Astrozyten, eine der
Untergruppen der
Gliazellen. Werden die Astrozyten
beschädigt oder gar durch Entzündungsprozesse zum
Absterben gebracht, gerät das Gehirn in seiner Funktion quasi
im Umfeld der abgestorbenen Neuro-Gliazellen (z.B.
Astrozyten) außer Takt. So sind sich die führenden
Neurologen heute in der Forschung einig (Stand
2008 [41]),
die Gliazellen (insb. Astrozyten)
spielen eine Schlüsselrolle bei Erkrankungen des
Nervensystems (insb. ZNS) wie
z.B. neuropathische Schmerzen, Epilepsie und Alzheimer (DAT),
Phobien, Schizophrenie und Depressionen.
|
|
|
|
|
|
Es gibt, wie
im vorherigen Absatz schon erwähnt,
Gliazell-Untergruppen (Glia-Subtypen
/ Gliazelltypen).
|
|
|
|
|
|
Als erstes möchte
ich hier die radialen Gliazellen (Radialglia)
nennen, da sie inzwischen - unter vielen Neurowissenschaftlern -
als Vorläufer der Nervenzellen im ZNS gelten. Einige
Wissenschaftler halten die Gliazell-Untergruppe der radialen
Gliazellen für die Vorläufer der Nervenzellen, weswegen
sie auch die Meinung vertreten, das es sich bei ihnen um die
eigentlichen Stammzellen des Gehirns handelt. Alledings
sollen sie diese Stammzellen-Fähigkeit nur im embryonalen
Stadium besitzen, im erwachsenen Alter haben sie diese Eigenschaft
(Neurogenese: Wandlung Glia- zur
Nervenzelle) scheinbar nicht mehr, mit Ausnahme im
Hippocampus (Großhirn-Bereich der
Gedächtniskonsolidierung) und im Riechkolben
(Bulbus olfactorius) [41].
Ist hier z.B. ein Zusammenhang zwischen den ersten klinischen
Zeichen von Alzheimer (DAT) und der
Beeinträchtigung/ /Schädigung der Gliazellen zu suchen,
bei Alzheimer sind die ersten Symptome u.a. Riechverlust.
|
|
|
|
|
|
Als
zweites möchte ich die wichtige
Untergruppe der sogen. Mikrogliazellen (Mesoglia
o. Hortega-Zellen) vorstellen, sie stellen im Prinzip
Immunzellen dar und werden zur Zellgruppe der Makrophagen gezählt
(siehe auch Seite: Immunorgane / Disposition
/ Kreuzreaktion u. [Q]).
Die Mikrogliazellen entstammen im Gegensatz zu den anderen
Gliazellen, aus Vorläuferzellen des blutbildenden Systems.
Sie sind quasi die Abfallbeseitigung im ZNS,
ähnlich den Makrophagen des Blutsystems und anderer Gewebe.
Sie beseitigen z.B. Reste abgestorbener Nervenzellen und
Oligodendrozyten mittels Phagozytose (Aufnahme
u. intrazelluläre Verdauung). Die Mikrogliazellen
können ähnlich den Makrophagen Antigene (z.B.
Bestandteile von Viren, Baktereien etc.) zusammen mit dem
entsprechenden Körpereigensignal (MHC
II-Faktor) präsentieren, weswegen sie zu den sogrn.
“professionellen antigenpräsentierenden Zellen“
(Immunzellen: dendritische Zellen,
B-Lymphozyten, Monozyten u. Makrophagen) zugeordnet werden.
Die Hauptaufgabe dieser Immunzellen ist die für die
T-Lymphozyten (T-Zellen) aufbereitete
Antigenpräsentation. Durch diese Antigenpräsentation
werden dann noch nicht aktivierte, sogen. naive T-Lymphozyten
aktiviert, die vorher noch kein Kontakt zum entsprechenden Antigen
hatten. Die Mikrogliazellen kommen im ZNS als ruhende und
aktivierte Formen vor. Die ruhenden Mikroglia-Zellen treten
nie zusammengeballt auf, vielmehr haben sie immer einen bestimmten
Abstand zueinander. Erst nach einer Aktivierung sammeln sie
sich die Reaktiven-Mikroglia-Zellen am Ort des Geschehens,
wo sie dann mittels Phagozytose (Aufbereitungs-
u. Fress- vorgang) und Exozytose (Stoff-Freisetzung)
durch Ausschüttung zytotoxischer Substanzen
(Wasserstoffperoxid / H2O2
und Stickstoffmonoxid / NO) das entsprechende
Ziel (z.B. Krankheitskeim,
Zelltrümmer etc.) auflösen und beseitigen.
Nach Erfüllung dieser Aufgabe schütten sie dann u.a.
die Zytokine IL1, TNF-a und IF-g
aus, was weitere Immunreaktionen auslöst
(inhibiert) aber auch
Astrozyten anregt sich zu teilen (Poliferation)
und Reparaturmechanismen einleitet deren folge dann sogen.
Glianarben bzw. Gliasklerosen sind (Gliasklerosen
siehe oben Kap.: Was bezeichnet man als Multiple Sklerose
(Encephalomylitis Disseminata).
|
|
|
|
|
|
Die
Untergruppe der sogen. Hüll- oder Isolierzellen bzw. den
Oligodendrozyten (Oligodendroglia)
sind für die elektrischen
isolierung der Nervenfasern (Axone)
verantwortlich und halten diese am Leben. Die
elektrische Isolierung der Neuronen-Axone
(Nervenzellfortsätze) geschieht
mittels ihrer aus Myelin (lipidreiche
Ummantelung) bestehenden Zellfortsätze, welche die
sogen. Markscheiden bilden. Die Oligodendrozyten sind
phylogenetisch mit den sogen. Satelitenzellen der Großhirnrinde
verwandt. Oligodendrozyten reagieren, sowie auch Neuronen, sehr
empfindlich auf eine Erhöhung des Neurotransmitters Glutamat.
Schon eine geringe Glutamat-Konzentrationserhöhung kann zum
Zelltod dieser Zellen führen (siehe
Abs. Astrozyten, Bildung von Glutamat). Der Pendant des
Peripheren Nervensystems / PNS zu den
Oligodendrozyten sind die sogen. Schwanschen-Zellen
(Schwann-Zellen
o. Gliocytus periphericus), die für die elektrische
Isolierung der Axone der peripheren Nervenzellen verantwortlich
sind. Dies gelingt ihnen durch mehrfaches umwickeln der Axone. Die
Isolierwirkung beruht auf ihren hohen Myelin-Gehalt
(Membranlipidde), weswegen die
Isolierummantelung der Axone auch Myelinscheide genannt wird.
|
|
|
|
|
|
Auch die
sogen. Ependym-Zellen und Plexusepithelzellen zählen
zu den Gliazellen. Die Ependym-Zellen kleiden vor allem die
Liquor-Hohlräume des Gehirns (Ventrikelsysteme)
und den Zentralkanal des Rückenmarks aus. Auch das Epithel
des Plexus choroideus wird aus spezialisierten Ependym-Zellen, den
Plexusepithelzellen gebildet. Beim Plexus choroideus
(Plexus chorioideus) handelt es
sich um komplexe Adergeflechte welche in die
Ventrikelsysteme als Blutgefäßknäulen hineinragen
und für die Ultrafiltration des Blutes zur Neubildung des
Liquors (liquor cerebrospinalis, Gehirn-
u. Rückenmarksflüssigkeit) verantwortlich
sind, daneben sorgen sie auch für eine erhöhte
Natrium- und Magnesiumkonzentration gegenüber dem Blutsystem
im Liquorraum. Es handelt
sich hierbei also um Bereiche, in denen der Stoffwechselaustausch
zwischen Gehirn (Liquor) und Körper
(Blut) stattfindet.
Im wesentlichen handelt es sich bei dem Plexus choroideus um eine
Einstülpung der weichen Hirnhaut (Pia
mater / siehe auch Abs. Astrozyten). Erkrankungen bzw.
Entzündungen in diesem Bereich nennt man Ependymitis, die
u.a. bisher insbsondere bei folgenden Infektionen beschrieben
wurde: Toxoplasmose und Syphilis - letztere eng verwand mit der
Borreliose!
|
|
|
|
|
|
Die
Gliazell-Untergruppe die für uns in Zusammenhang mit einer
Borreliose und ihrer Symptome am interessantesten erscheint, sind
die Astrozyten (Astroglia,
Sternzellen o. Spinnenzellen), von
denen einige den Neuronen (Nervenzellen)
sehr ähnlich sind, sie
sind quasi die Taktgeber des Gehirns. Da
sie eine stern- bzw. spinnenartige Form besitzen, haben sie
hiernach ihren Namen erhalten (griechisch
astron = Stern). Die sternförmigen Fortsätze
bilden die Grenzmembran zu den Blutgefäßen und zur
Oberfläche des
Gehirns, der weichen Hirnhaut (sogen.
Pia mater). Die weiche Hirnhaut (Pia
mater) umspannt das komplette Gehirn und Rückenmark
(ZNS) mit all seinen Furchen und
Einstülpungen, sie besteht vor allem aus
weichen Bindegewebe das von vielen Blutgefäßen
durchzogen wird. Die Kombination Bindegewebe (=
Rückzugsort der Borrelien), Blutgefäße
und Gliazellen (Myelin) macht
diese so interessant in Zusammenhang einer Borrelien-Infektion und
Multiple Sklerose (MS), Alzheimer
(ADT)
und einige anderer Syndromen. Erste klinische Symptome
einer Reizung (Hirnhautentzündung /
Meningitis) sind i.d.R. Kopfschmerzen, Licht- und
Geräuschempfindlichkeit - alles auch Symptome einer
chronischen Borreliose (siehe auch
Seite: Symptome und Merkblatt, Diagnose, gestörtes EEG).
Die Astrozyten kommunizieren nicht mit
elektrischen Signalen, sondern mit biochemischen Botenstoffen.
Die Kommunikation zwischen den Neuronen (Nervenzellen)
und Astrozyten geschieht z.B. über den Einstrom von
Kalzium in die Astrozyten, wodurch diese dann angeregt
werden Glutamat, den wichtigsten Neurotransmitter
auszuschütten. Die verstärkte Freisetzung
des Glutamates der Astrozyten führt dann zur
Gleichschaltung (Synchronisation)
der neuronalen Aktivität. Durch diese
Gleichschaltung geben in Folge vorab unkoordinierte
Nervenzellen für einen gewissen Zeitraum synchrone
Impulse ab. Eine einzige Astrozyten-Zelle kann auf diese Weise
z.B. im Hippocampus 140.000 Nervenzell-Synapsen beeinflussen.
Eine gesunde Synchronisation der einzelnen
Nervenzellvebände gilt inzwischen als
Verantwortlich für die Lern- u. Merkfähigkeit
(kognitive Leistungen) und so auch
für das Bewusstsein. Der Pendant des PNS (Peripheren
Nervensystems) zu den Astrozyten des ZNS sind die
sogenannten Amphizyten (Satelitenzellen
o. Mantelzellen), die einschichtig die Nerven und Ganglien
(siehe oben) des PNS umkleiden und
für dessen Energieversorgung verantwortlich sind.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nerven
– Aufbau des Zentral- (ZNS) und peripheren Nervensystem (PNS)
/ vereinfacht dargestellt
|
|
|
|
|
|
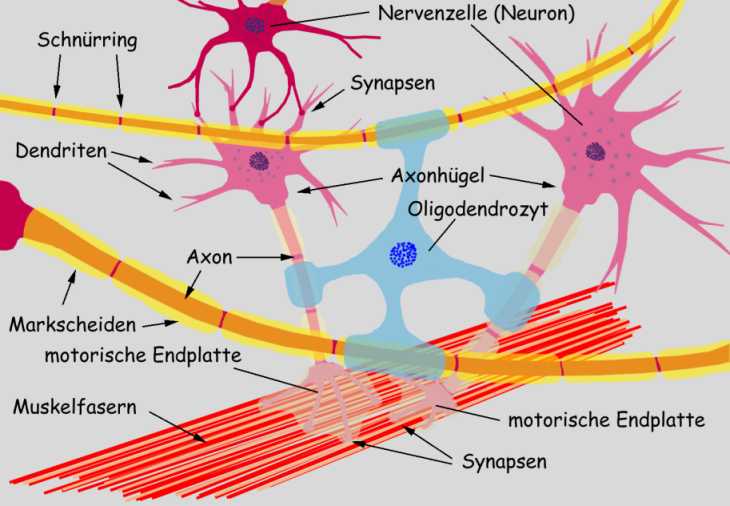
Entwurf
u. gez.: A. Hartwig
|
|
|
|
|
|
|
|
|
|
|
|
Die einzelnen
Nervenfasern bilden zusammen die Nervenleitbahnen der
motorischen und sensorischen Nerven des PNS, sie werden durch
drei Bindegewebsschichten geschützt. Die erste Schicht
befindet sich unmittelbar als lockeres Bindegewebe (1. Schicht)
zwischen den einzelnen Nervenfasern, die zweite straffe Schicht
bildet eine Bindegewebshülle (2. Schicht) und bündelt
die einzelnen Nervenfasern zu sogen. Faszikel
zusammen. Die einzelnen Faszikel werden dann
wiederum nochmals von einer weiteren Bindegewebshülle (3.
Schicht), dem sogenannten Epineurium umgeben. Das Ganze ergibt
dann einen motorischen oder sensorischen Nerv des PNS bzw.
Spinalnerven - siehe nachfolgende Abb..
|
|
|
|
|
|
Nervenaufbau
des peripheren Nervensystems (PNS) / vereinfacht dargestellt
|
|
|
|
|
|
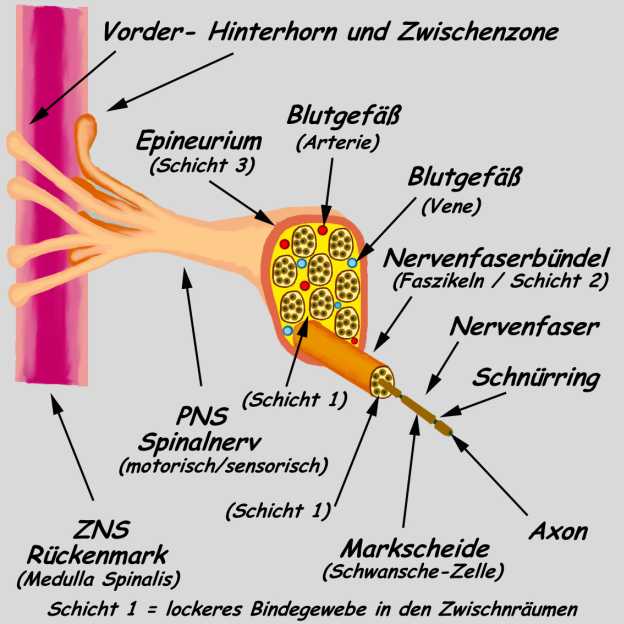
Entwurf
u. gez.: A. Hartwig
|
|
|
|
|
|
Blutgefäße
(Arterie u. Vene) siehe unter [K]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hirn- u.
Rückenmarksflüssigkeit oder Liquor cerebrospinalis /
Blut-Hirn-Schranke:
|
|
|
|
|
|
Das gesamte
ZNS wird von der sogenannten Blut-Hirn-Schranke umhüllt
und so gegen den Rest des Körpers abgegrenzt (siehe
oben Kap.: Aufbau der Nerven des
ZNS und PNS, Abs.: Ependym-,
Plexusepithelzellen u. Astrozyten).
Die Blut-Hirn-Schranke ist die Grenze zwischen dem
Blutkreislauf und dem Nervenwasser (auch:
Hirnwasser o. Rückenmarksflüssigkeit genannt / Liquor
cerebrospinalis), sie bildet quasi einen weiteren
Schutzwall gegen eingedrungene Krankheitskeime. Das
Nervenwasser bildet auch
den mechanischen Schutzmantel (Wasserpolster)
für das Gehirn (bzw. ZNS)
und es ist für den Stoffwechselaustausch
zwischen ZNS und Körper verantwortlich. Das
Nervenwasser ist normalerweise eine klare, wasserhelle, sehr
eiweißarme Flüssigkeit. Bestimmte Veränderungen
des Nervenwassers wie z.B. erhöhte Eiweißgehalte,
vermehrte Immunzellen- und Antikörper-Anwesenheit können
für eine Aufweichung bzw. Störung der
Blut-Hirn-Schranke sprechen. Die Zusammensetzung des
Nervenwassers spielt somit labortechnisch bei der
Diagnostik eine wichtige Rolle, so auch bei der
Neuro-Borreliose (NB, C-NB o.
zerebrovaskuläre Borreliose) und dem MS-Syndrom
(MS). Zur Aufweichung der
Blut-Hirn-Schranke bedarf es vorerst keiner
Autoimmunaggresionskrankheit, sondern einzig und allein genügt
hier anfangs eine
systemische Entzündung (siehe
Seite Symptome: Punkt [23]). Die Folge kann,
muss nicht, dann eine Autoimmunaggresionskrankheit sein
wenn sich im Blut Antikörper oder Immunzellen durch eine
Infektion (z.B. Borreliose) befinden
die dem ZNS-Strukturen ähnlich (es
genügt ca. 50 % Ähnlichkeit) sind. Diese können
dann durch die Aufweichung der Blut-Hirn-Schranke ins Gehirn
gelangen, dort Kontakte zur Körpereigenstrukturen eingehen
die vorher für diese nicht erreichbar waren und so durch
positive Rückmeldung (Kontakt zum
vermeintlichen Ziel-Antigen) zur Vermehrung dieser
Autoaggression führen.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vermutete
Faktoren die zur Empfänglichkeit des MS-Syndroms führen
können:
|
|
|
|
|
|
Zuerst
drängt einem natürlich der Verdacht auf, das es sich
beim MS-Syndrom um eine Erbkrankheit (Genfehler)
handeln könne - aber hiergegen sprechen viele
Untersuchungen und Beobachtungen.
|
|
|
|
|
|
So
z.B. Beobachtungen das bestimmte Völker erheblich häufiger
am MS-Syndrom leiden als andere [1],
zwängen einem natürlich geradezu die erbliche Komponente
auf. Auch die Beobachtung das Geschwister einem 6- bis 22fachen
höheres Risiko unterliegen an MS zu erkranken [1]
könnte auch ein Hinweis auf einen vererbten Genfehler sein.
Aber absolut betrachtet bekommen nur circa 0,5-1,5 % der
Geschwister von MS-Patienten selbst das MS-Syndrom und alle
anderen Verwandten unterliegen diesem Risiko unter 1 % [1].
Der Befund allein spricht schon dafür, dass es sich nicht
um einen vererbbaren Genfehler handelt. Allerdings findet
man bei MS-Patienten, z.B. in Mittel- und Nordeuropa, häufiger
bestimmte Erbanlagen als in der nicht am MS-Syndrom erkrankten
Bevölkerung. Hierbei handelt es sich in erster Linie
um nachfolgende Körpereigenstrukturen
(Selbstantigene): HLA DR2, DW2,
B7, A3. Personen mit dem HLA DR2 Faktor haben z.B. ein
vierfach höheres Risiko das MS-Syndrom zu bekommen (Risiko
ca. 1 : 250), als Personen dessen entsprechende Zellen nicht
diesen Faktor (Selbst-Antigen) tragen
[1/23]. Diese Beobachtungen
sprechen natürlich für eine gewisse erbliche
Vorbelastung, bzw. Bereitschaft, am MS-Syndrom zu erkranken.
Aber insgesamt betrachtet spricht alles eher dafür das nicht
die Erkrankung selbst vererbt wird, sondern nur eine gewisse
Erkrankungsbereitschaft bzw. Veranlagung besteht - der Fachmann
spricht dann von Disposition oder Prädisposition
[D].
|
|
|
|
|
|
Betrachtet
man die einzelnen Volksgruppe und Rassen, dann erhält man
Folgendes Bild über die MS-Bereitschaft. Es scheint
Volksgruppen zu geben die eine geringe, und Volksgruppen die eine
höhere bis starke MS-Bereitschaft (Disposition)
in sich tragen. So hat sich in den bisherigen
Studien gezeigt, dass z.B. kaukasische Rassen ein
erheblich höheres MS-Risiko aufweisen, als afrikanische und
asiatische Rassen [40]. Obwohl
diese These meiner Meinung nach nicht vollkommen stimmig ist, da
z.B. Slowenien - zumindest heute - zu den Ländern mit
geringer MS-Häufigkeit gezählt wird (siehe
Abs.: Die Häufigkeit der MS-Fälle ein Ergebnis der
frühen Diagnose, MS oder Borreliose?). Slowenien hat
daneben eine Eigenschaft, die nur wenige andere Staaten besitzen.
Der kleine Staat Slowenien ist so gut wie ethnisch rein, die
Bevölkerung besteht vorrangig aus einer slawischen
Volksgruppe (Slawen- bzw. Slaven-Anteil >
90 %). Die Ursprünge der Slowenen kann nach Meinung
einiger Fachleute auf eine Volksgruppe zurückverfolgt werden,
den sogenannten urslawischen Venetern. Die Veneter sollen das
erste Volk in Mitteleuropa gewesen sein, das von den
indoeuropäischen Völkern abstammt [11].
Die slowenische Sprache (Wortschatz)
weißt auf eine enge Völker-Verwandschaft zu den
Bretonen und Letten hin. Somit zählen die Slowenen mit
ziemlicher Sicherheit nicht zu den Rassen mit geringer
MS-Bereitschaft, sondern eher zur Gruppe der indoeuropäischen
Bevölkerung der wir Deutschen auch zugerechnet werden müssen.
Somit sollten die Slowenen eigentlich eine ähnlich hohe
MS-Bereitschaft aufweisen, wie wir Deutschen. Ich mache für
die unterschiedliche MS-Häufigkeit
(Deutschland/Slowenien) daher auch eher die verschiedenen
Gesundheitssysteme verantwortlich (siehe
unten: Die Häufigkeit der MS-Fälle ein Ergebnis der
frühen Diagnose, MS oder Borreliose?).
|
|
|
|
|
|
Hier,
in der generellen unterschiedlichen MS-Bereitschaft der
verschiedenen Volksgruppen kann schon der Zusammenhang zu
Borrelien liegen. So deckt sich z.B. das
Haupt-Verbreitungsgebiet der Lyme-Borrelien
(Bb.sl.-Komplex / Bb.-Geno-Typ 1-15)
so ziemlich mit dem geographischen Lebensraum der am meisten
von der MS-Syndrom betroffenen Volksgruppen. Es darf als
erwiesen betrachtet werden, das die Borrelien in laufe der
Evolutionsgeschichte gelernt haben mit ihren Stapelwirten (Tier
u. Mensch) zusammen zu leben. Das bedeutet, die
Borrelien haben sich den Gewebe-Strukturen (Selbst-Antigene)
und der Immunreaktionen (z.B.
Komplementensystem) der Wirte angepasst um in ihnen
möglichst unbehelligt länger zu überleben. Das
heißt, sie wollen keine heftigen Immunreaktion beim
Eindringen und später im Wirt auslösen, da sie ja
z.B. im Gegensatz zum Grippevirus den Wirt für längere
Zeit zum Fortbestand benötigen um ihrem Nachwuchs die
Change zu geben in einen neuen Vektor (z.B.
Zecke) zu gelangen. Da bekanntlich die Zecken
jahreszeitlich im Jahres-Zyklus unterschiedlich stark auftreten,
müssen sie mindestens dafür sorge tragen das der Wirt
für länger als ein Jahr bedingt mobil und
überlebensfähig bleibt. Gewisse Beeinträchtigungen
des Wirtes (z.B. Mensch) die z.B.
durch zytotoxische Immunreaktionen auf die Borrelien entstehen,
welche aber die Borrelien selbst eher weniger treffen, dürfen
sicherlich als “gewollte“ Reaktionen betrachtet werden.
Führen diese Reaktionen doch zu Symptomatiken die eine
Borrelien-Weiterreichung auf den nächsten Wirt mittels
Vektor (Zecke) wahrscheinlicher
machen - wie z.B.:
|
|
|
|
|
|
Gelenkschmerzen
und Gleichgewichtsstörungen: der Wirt bewegt sich
langsamer und strauchelnd durchs Gelände, wodurch
Zeckenansitzen weniger gut ausgewichen werden kann.
|
|
|
|
|
|
Berührungsmissempfindung:
der Wirt merkt hierdurch weniger gut das eine Zecke auf ihm eine
Saugplatz sucht und Blut saugt.
|
|
|
|
|
|
Verschlechterung
das Kontrastsehens: der Wirt übersieht im Halbdunkel der
Zecken-Lebensräume diese eher auf ihren Ansitzen sowie auf
sich selbst am Abend bevor er sich zum Schlafen legt.
|
|
|
|
|
|
Regulierung
des Immunsystems und Autoimmunreaktionen: die Immunabwehr
greift hierdurch die Borrelien weniger an und wird ggf. von ihnen
abgelenkt, hierdurch überleben diese länger im Wirt. Es
könnten an dieser Stelle noch mehr Beeinträchtigungen
des Wirtes genannt werden.
|
|
|
|
|
|
Ob
die Beeinträchtigungen von den Borrelien “gewollt“
sind lässt sich wohl eher weniger beweisen, die Idee möchte
ich aber durchaus in den Raum stellen.
|
|
|
|
|
|
Das
Parasiten bzw. Krankheitskeime
(Bakterien, Pilze etc.) durchaus
ihre Wirte “gewollt“ beeinflussen, diese Beobachtung ist
an verschiedenen Beispielen in der Wissenschaft bekannt. Eine der
extremsten Beobachtungen konnte bei der Beziehung zwischen vier
Pilzarten (Ophiocordyceps
unilateralis)
und seinem Wirt, den Ameisen (Rossameisen
/ Camponotus)
beobachtet und wissenschaftlich gesichert werden. Die Pilze
manipulieren ihre in den Baumkronen lebenden Wirte (Ameisen)
so, dass sie zum Boden absteigen wo für den Pilz bzw. seinem
Sporen günstige Überlebens-Bedingungen herrschen. Dort
tötet der Pilz dann die Ameise die er befallen hat, bildet
anschließend einen neuen Fruchtkörper mit Sporen, die
dann neue Ameisen befallen [105]. Da
dieses Verhältnis so extrem offensichtlich ist, gibt es hier
keine Zweifel. Bei den Borrelien ist dies sicherlich in puncto
“gewollt“ Wirt-Beeinflussung nicht sicher zu sagen, aber
die auftretende Symptomatik spricht in vielen Punkten dafür.
Aber auch schon weniger offensichtliche Parasit-Beeinflussungen
des Wirtes, durch sogenannte Parasitokine, das sind
Parasitenmoleküle die dem Zytokinen des Wirtes sehr ähnlich
sind, konnten beobachtet werden (z.B.
bei Namatoden, Metazoen usw.) [106].
Muss zu diesen Parasitokinen auch das "Bbtox 1" gezählt
werden?
|
|
|
|
|
|
Das
Risiko am MS-Syndrom zu erkranken ist auf der Welt von Region
zu Region sehr unterschiedlich, am häufigsten tritt
das MS-Syndrom in den eher gemäßigten Klimazonen
auf (siehe Seite: Prävalenz bzw.
Verbreitung Borreliose / Multiple Sklerose) - z.B. in
Mittel- und Nordeuropa [1]. Auch auf
dem Nordamerikanischen Kontinent tritt das MS-Syndrom häufiger
in den Nordstaaten auf als in den Südstaaten [1].
Auf der Südhalbkugel der Erde sieht es ähnlich mit der
Häufigkeitsverteilung aus. Je weiter vom Äquator
entfernt, um so höher die MS-Syndrom- Prävalenz. Dieser
Befund schließt so gut wie aus das alleine die erbliche
Veranlagung (Disposition) am
MS-Syndrom schuld ist, vielmehr muss wohl mindestens ein zweiter
Faktor mit ins Spiel kommen, der mehr oder weniger an
bestimmte Regionen der Erde gebunden ist (Umweltfaktor
- z.B. Krankheitskeim).
|
|
|
|
|
|
Weiter
haben bisher gesammelte Daten gezeigt das es sich beim
Umweltfaktor der den Ausbruch der MS begünstigt, mit sehr
großer Wahrscheinlichkeit um einen Faktor handelt, der wenn
er vor dem 15. Lebensjahr (Pubertät /
siehe auch unten: HMO-MS-Theorie) eintritt, mit in andere
Regionen verschleppt werden kann. Personen die vor dem 15.
Lebensjahr ihr Geburtsland verlassen, erlangen das
MS-Syndrom-Risiko des neuen Heimatlandes (hoch
oder niedrig). Personen die im höherem Alter ihr
Heimatland verlassen, nehmen das Erkrankungsrisiko des
Ursprunglandes mit. Dies haben Migrationsstudien gezeigt
[1/23].
|
|
|
|
|
|
Wegen
dieser Beobachtung wurden schon verschiedene Einflüsse in
Fachkreisen diskutiert, so z.B. UV-Einstrahlung (bzw.
Sonnenscheindauer), Niveau der Zivilisation,
Industrieeinflüsse (Schadstoffe),
sozialer Status und vieles Mehr. Aber all diese Einflüsse
scheinen bei genauerer Betrachtung nicht als Basis-Ursache für
das Ausbrechen des MS-Syndroms haltbar zu sein - siehe z.B. [1].
Am wahrscheinlichsten erscheint ein Zusammenspiel von
Ernährungs-physiologischen Einflüssen, einer
schleichenden, persistierenden bzw. latenten Infektion (z.B.
slow-virus Erkrankung / systemischen Entzündung)
sowie die Ausreifung des Thymus. Der
Thymus ist ein sehr wichtiges Organ zur Heranreifung und
Ausbildung eines funktionierenden Immunsystems. Allerdings
bildet sich das Thymus-Organ schon ab den Pubertätalter
zurück (sogen. Involution),
wodurch auch teilweise die unterschiedliche Erkrankungsverläufe
im Kinds- und Erwachsenenalter erklärt werden können
(siehe
zu Thymus auch Seite: Merkblatt, Kap.: Tarnstrategien
der Borrelien-Subspezies, Abs.: Natürliche Killerzellen).
|
|
|
|
|
|
Die
Art der Ernährung gerät ins Blickfeld, da bekannt
ist das bestimmte in der Nahrung enthaltene Stoffe (z.B.
Vitamin B12, Folsäure etc.) ein positiven Einfluss
auf die Markscheidenbildung (Myelinhüllen)
beim Nervenaufbau inne haben. Die These in Bezug auf die
Ernährung erscheint aber bei genauerer Betrachtung auch nur
geringere Bedeutung zuzukommen, da z.B. dünnere Markscheiden
sicherlich anfälliger für die angeborene unspezifische
Immunabwehr sind (sogen. Komplementensystem)
aber die spezifischen Immunabwehr (T-Zellen,
Antikörper etc.) erst locker lässt wenn der
vermeintliche Feind eliminiert ist - ob dick oder dünn. So
kann die Ernährung mit großer Wahrscheinlichkeit zwar
einen Einfluss auf den Verlauf (z.B.
Schwere) haben, aber weder den Ausbruch initiieren noch
gänzlich verhindern. Dünne Markscheiden können
den Ausbruch des MS-Syndroms sicherlich wahrscheinlicher machen,
aber sind mit Sicherheit nicht die eigentliche auslösende
Ursache (siehe unten: HMO-Theorie).
Unter diesem Aspekt erscheint eine schleichende,
persistierende oder latente Infektion als möglicher
Initialfaktor für einen späteren MS-Syndrom-Ausbruch als
wesentlich wahrscheinlicher. Zumal es sich nach heutigem
Wissen (Stand 2003 [24])
beim MS-Syndrom um einen Entzündungsvorgang handelt, der
zum Großteil unter der klinischen Wahrnehmung stattfindet.
So werden vom MS-Patienten eigentlich erst die größeren
Entzündungsherde als Symptome wahrgenommen, nicht aber der
eventuell ständig schwellende “breitflächige“
Entzündungsprozess (siehe auch
Seite: Symptome, Punkt [23] Systemische Entzündung).
So konnte in Tierversuchen anhand von Rheuma gezeigt
werden das eine ständige Infektion, z.B. mit Borrelia
burgdorferi (Bb.ss.), zur
Produktion von autoreaktiven Antikörpern (ar-AK),
dem sogenannten Rheumafaktor (RF)
führen kann (Stand 2005 [27]).
So denke ich was die Gelenke betreffend das Rheuma ist, welches
durch eine ständige Borrelien-Infektion bedingt sein kann,
ist das MS-Syndrom der Pendant hierzu im Gehirn und Rückenmark
(ZNS) - doch hierzu mehr im Abs.:
“slow-disease MS-Theorie“.
|
|
|
|
|
|
Als
weitere mögliche Ursache oder begünstigenden Faktor
für Autoimmunerkrankungen, wie z.B. rheumatische
Arthritis, Multiple Sklerose oder Systemische
Sklerose könnten
nach Meinung einiger Forscher, Zellen von Ungeborenen
(sogen. fetale Zellen) in Betracht
kommen [18]. Bei dieser Theorie
geht man davon aus das während der Schwangerschaft Zellen des
Embryos ins Blut der Mutter gelangen, dort nicht gleich vom
Immunsystem zerstört werden, da ihre Oberflächenproteine
derer der mütterlichen Zellen sehr ähnlich sind. Dort
können sie dann nach Beobachtungen der Forscher
jahrzehntelang im Blut der Frauen (Mütter)
überleben. Diese
Theorie würde natürlich
erklären warum wesentlich häufiger Frauen z.B. am
MS-Syndrom leiden als Männer, aber nicht warum auch Männer
unter MS leiden können
(Verhältnis Frauen : Männer = 3 :
2 bis 2 : 1). Diese Theorie der MS-Entstehung kommt daher
für mich (A. Hartwig), wenn
überhaupt, nur für einen geringen Prozentsatz unter den
Frauen (Mütter) in Betracht.
Zumal Männer (Väter),
die unterm MS-Syndrom leiden, doppelt so häufig die
Empfänglichkeit für MS an ihre Kinder weiterreichen als
Frauen (Mütter) [19].
|
|
|
|
|
|
Hier
kommt nach meiner Meinung ein Faktor zum Tragen den man in der
Vererbungslehre (Genetik i.S. von Mendel)
„Erbgang“ nennt, hiermit ist die Vererbung von
dominanten Merkmalen an die Nachkommen gemeint - z.B. wie stark
(dominant) die männlichen
Merkmale (kantiges Gesicht,
Orientierungssinn etc.) und der hiermit zusammenhängende
Hormonhaushalt (z.B. Testosteron)
aktiv ist. Jenachdem wie stark aktive männliche Gene
vererbte werden, könnten dann im Zusammenhang mit dem
nachfolgenden Umstand, mehr oder weniger Myelin und
Oligodendrozyten, dazu führen das die Väter die
Bereitschaft am MS-Syndrom zu erkranken quasi ihrem Nachwuchs mit
in die Wiege legen. Es gibt nämlich Hinweise darauf, dass das
Hormon Testosteron die Menge der im Gehirn produzierten weißen
Substanz (Oligodendrozyten etc.)
beeinflusst [20].
|
|
|
|
|
|
Es
konnte nämlich in Tierversuchen (Mäuse)
gezeigt werden, dass das ZNS männlicher Mäuse mehr
Myelin enthält als das der Weibchen. Myelin ist
die Substanz aus dem die Markscheiden der Nerven vorrangig
bestehen, es ist quasi der Stoff der die Isolierung der Nerven
bildet (siehe oben: Aufbau der Nerven
des ZNS und PNS). Auch bei den Produzenten des Myelins,
den Oligodendrozyten, gibt es diesen markanten Unterschied. Im
männlichen ZNS kommen diese spezialisierten Zellen
(Oligodendrozyten) ein Drittel
häufiger vor als im weiblichen ZNS [20].
Außerdem scheinen die Oligodendrozyten im männlichen
ZNS wesentlich länger zu leben, als die im weiblichen ZNS
[20]. Je mehr Zellen aber absterben,
um so aktiver müssen entsprechende Immunzellen (Fresszelle,
z.B. Mikrogliazellen) sein die jene toten Zellen
beseitigen. Im Umkehrschluss bedeutet der Umstand das im
weiblichen Gehirn eine doppelt so hohe immunologische Aktivität
herrschen muss, als im männlichen Gehirn. Die abgestorbenen
Zellen (Oligodendrozyten) müssen
ja beseitigt werden, enthalten diese intrazelluläre Erreger
(Viren o. Bakterien, z.B. Borrelien)
kommt das Immunsystem mit ihnen auch zwangsläufig häufiger
in Kontakt. Dieser Umstand und der das im weiblichen Gehirn
weniger Myelin (Nervenisolierung)
vorkommt, mag bei der Disposition der Frauen durchaus von
Bedeutung sein.
|
|
|
|
|
|
In
diese Hormon-Myelin-Oligodendrozyten-MS-Theorie (HMO-MS-Theorie)
passt auch der Befund das nur circa 5 % der MS-Fälle vor
dem 16ten Lebensjahr ausbrechen [21],
erst mit der hormonellen Umstellung des Körpers (Pubertät)
tritt das MS-Syndrom gehäuft in Erscheinung. Im
Lebensabschnitt der Pubertät kommen somit gleich drei
Faktoren zum tragen. Zum einen die HMO-MS-Theorie, zum andern das
während der Pubertät das gesamte Gehirn sich neu
organisiert und das ab dieser Zeit der Thymus ausgereift ist und
beginnt sich zurückzubilden (sog.
Involution, siehe oben Kap.: Vermutete
Faktoren die zur Empfänglichkeit des MS-Syndroms führen
können). In Bezug auf die
Neuorganisation des Gehirns bedeutet dies, es werden verstärkt
neue Verknüpfungen unter den Nerven (Neuronen)
gebildet, mit Aussprossung von neuen Axonen und Dendriten. Das
Gehirn bekommt weniger, aber dafür schnellere Verbindungen
[22]. Was wiederum zur Folge hat das
auch verstärkt neue Markscheiden (Myelin,
Isolierungen) gebildet werden, welche anfangs sicherlich
sehr dünnschichtig sind und somit anfällig gegen
Beschädigungen bei Entzündungen. In manchen Bereichen
des Gehirns beträgt der Anteil der grauen Substanz
(Zellkörper u. Synapsen) vor
der Pubertät über 50 %, zwischen dem 12. und 20.
Lebensjahr sinkt der Anteil der grauen Substanz dann drastisch ab.
Teilweise macht sie in manchen Hirnregionen dann nur noch ein
Anteil von 10 % aus [22]. Es
verschiebt sich somit das Verhältnis grauer zur weißer
Hirnsubstanz. Waren bis zur Pubertät motorischen
Neuronen und Interneuronen (Bestandteile
der grauen Substanz) in Überfluss vorhanden, sind
sie nach der Wandlung vom Kind zum Erwachsenen auf ein Minimum
beschränkt. Fehler, wie z.B. Entzündungen mit
Entmarkung der Nerven, machen sich somit wohl auch eher
klinisch durch entsprechende Symptome bemerkbar - es
gibt keine Umleitungen mehr (Ersatz für
einen Defekt) auf die das ZNS/PNS-System ausweichen kann.
|
|
|
|
|
|
Die
Isolierung der grauen Substanz wird in erster Linie aus
Myelinhüllen, Gliazellen, dem sogenannten Nervenstützgewebe
gebildet (= weiße Substanz),
alles Bestandteile des Gehirns die vorrangig beim MS-Syndrom
angegriffen werden. Soweit zur wahrscheinlichen
Basisvoraussetzung zur MS-Bereitschaft, welche keine Erklärung
für den Initial-Auslöser des MS-Syndroms ist.
Beispiel: ein Elektrokabel mit dünner Isolierung ist auch gut
isoliert solange keine äußeren mechanischen oder
chemischen Einflüsse auf dieses Einwirken, wird aber bei
einem äußeren Einfluss schneller zerstört als ein
entsprechend robusteres Kabel mit dickerer Isolierung.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die
“slow-disease MS-Theorie“, der
wahrscheinlichste MS-Auslösefaktor?
|
|
|
|
|
|
Am
meisten ist unter der “slow-disease multiple sclerosis
theory“ (sdmst) die der
eines oder mehrerer slow-viren verbreitet, wofür auch
einiges spricht - aber es konnte wohl noch kein entsprechendes
Virus mit einem Immun-Reaktionsprofil ausgemacht werden, welches
alleine alle Voraussetzungen mit entsprechenden klinischen
(Symptome) und serologischen (z.B.
Antikörper) Muster erfüllt. Für Viren
spricht das sie in Zellen des Wirtskörpers ganz oder
teilweise überleben können, diese sogar zur Reproduktion
nutzen - aber z.B. auch Chlamydien und Borrelien können
entsprechenden Körperzellen befallen (siehe
z.B. [17]). Doch nun zuerst zu
der slow-virus MS-Theorie, weiter unten dann zu den Chlamydien und
Borrelien als Auslöser der MS.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Retro-Viren:
|
|
|
|
|
|
Da
bei in-vitro-Versuchen (im “Reagenzglas“)
mit B-Zellen von MS-Patienten gezeigt werden konnte, das DNA
von HER-Viren (HERV-H/RGH, HERV-W
u. ERV-9 / humane endogene retro-virus) reaktiviert
werden kann, sind diese Viren auch teilweise in Verdacht
geraten am MS-Syndrom beteiligt zu sein [41].
Man geht bei dieser These davon aus, dass endogene-retro-virus-DNA
bei einem “Infektionsunfall“ in die Keimzellen gelangte,
auf diese Weise latent (schlafend) im
Körper des Betroffenen ruht und irgendwann durch
entsprechende Lebensumstände reaktiviert wird. In wie weit
diese Retroviern an MS-Syndrom wirklich beteiligt sind, ist wohl
noch nicht ganz geklärt.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Slow-Viren:
|
|
|
|
|
|
Unter
den slow-Viren konzentriert sich der Verdachtsmoment
hauptsächlich auf Viren die entweder ähnliche
Genabschnitte (sog. Gen-Sequenzhomologie
bzw. Nucleotid-Reihenfolge), eine teilweise gleiche
Abfolge der Aminosäuren (Aminosäuren-Identität)
wie ZNS/PNS-Zellen besitzen und/oder aber Viren die
Zellen des ZNS/PNS als Ort ihrer Vermehrung (=
Replikation) oder Versteck vor der Immunabwehr nutzen.
|
|
|
|
|
|
Man
weiß aber auch das Bakterien, nicht nur Viren, diese
Voraussetzung erfüllen können. Die Bakterien hat man
in der Vergangenheit allerdings nicht soviel in Bezug auf die
Entstehung von MS beachtet, diese sind erst in letzten Jahren
immer mehr mit einbezogen worden - so z.B. Chlamydien (C.
pneumoniae). Aber zu den Bakterien, insbesondere zu den
Chamäleons unter ihnen, den Borrelien des Bb.sl-Komplex,
komme ich später (Bb.sl. etc. siehe
Seite: Merkblatt, Abs.: Tarnstrategien).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Neurotrope
Viren:
|
|
|
|
|
|
Jetzt
zurück zu den verdächtigen Viren, bei denen man von
neurotropen Viren spricht sofern sie als Rückzugsort bzw.
Replikationtsstätte auch - oder nur - Zellen des ZNS/PNS
aufsuchen. Hierzu kann man folgende Viren zählen:
Morbilli Virus (Masern),
Rubella Virus (Röteln),
Herpes Zoster Virus (HHV3
o. VZV [E]: Windpocken- und
Gürtelrose-Erreger) - die bei der MS-Diagnostik
in der sogenannten MRZ-Reaktion
zusammengefasst werden.
|
|
|
|
|
|
Als
weitere Viren kommen das humane Herpesvirus 6 (HHV6
[E]: Dreitagefieber, Exanthema
subitum, Enzephalitis [29]), Epstein-Barr-Virus
(HHV4 o. EBV [E]:
Pfeiffer'sche Drüsenfieber
und Burkitt-Lymphom), Hepatitis B Virus
(Leberentzündung, Gelbsucht)
sowie Adenoviren (Angina,
Bindehaut- u. Schleimhautenzündungen) als auch
bedingt das Influenza-Virus (Grippe)
in Betracht [23]. Die
Kreuzreaktion zwischen den entsprechenden vorgenannten Viren
und den Markscheiden des Gehirns soll durch Viren-Proteine
zustande kommen, die Ähnlichkeit zu nachfolgenden
Gehirn- bzw. Nervenbestandteilen aufweisen.
Myelin-Oligodendroglia-Glykoprotein (MOG),
myelinassoziertes Glykoprotein (MAG),
Proteolipidprotein (PLP) und
vorallem auf das basische Myelinprotein (engl.:
myelin basic protein / MBP) [23].
Das Epstein-Barr-Virus
überlebt z.B. in den menschlichen B.-Lymphozyten und führt
so zu lebenslanger Latenz. Durch entsprechende Lebensumstände
(Stress, Immunsuppression etc.) kann
es sporadisch zur Reaktivierung kommen. In den Kreis der
MS-Erreger ist das Epstein-Barr-Virus
wohl vorallem durch den EBVNA-1 Antikörper geraten,
den man in den oligoklonalen-Banden von MS-Patienten gefunden hat
[41].
|
|
|
|
|
|
So
spricht man z.B. dem Nachweis der sogenannten
polyspezifischen Immunantwort gegen neurotroper Vieren
(sogen. MRZ-Reaktion) einen
gewissen Stellenwert bei der MS-Syndrom-Diagnostik zu. Die
MRZ-Reaktion soll bei circa 94 bzw. 87 Prozent der
MS-Syndrom-Patienten labordiagnostisch ansprechen [26/27].
Bei der sogenannten MRZ-Reaktion werden verschiedene
neurotrope Viren zusammengefasst, wodurch sicherlich auch das hohe
Ansprechen von diesen Tests erklärt werden kann. Einzeln
betrachtet war das prozentuelle Ansprechen wie folgt: MRZ 7 %; MR,
RZ, MZ 53 %; M, R, Z 40 % [27]. Es
sollte aber nicht eine Reaktion auf nur einen dieser
neurotropen Viren als MRZ-Positiv gewertet werden, weil
dies die Gefahr birgt das eventuell eine aufkeimende oder
unterschwellige Infektion übersehen wird [28].
Aus diesem Grund sollte eine Befundbewertung der MRZ-Reaktion,
z.B. beim solitären Vorliegen einer
VZV-Antikörpersynthese-Erhöhung (VZV-AI-Erhöhung),
in Zusammenhang mit einer für das MS-Syndrom weniger
typischen oder klinisch mehrdeutigen Symptomatik vorsichtig
geschehen [28].
|
|
|
|
|
|
Für
einen Zusammenhang zwischen Viren und dem erneuten Auftreten von
MS-Syndrom-Verschlimmerungen (MS-Remission)
spricht das diese drei- bis fünfmal häufiger zeitlich
mit einer Virusinfektion (z.B. Grippe,
Influenza-Virus) auftreten sollen [23].
Allerdings muss kein direkter Zusammenhang bestehen, sondern die
Ursache kann auch indirekter Natur sein - z.B. durch eine
allgemeine erhöhte aktivierte Immunabwehrlage.
|
|
|
|
|
|
Eine
MRZ-Reaktion sowie der Nachweis von sogenannten oligoklonalen
IgG-Antikörpern ist aber keinesfalls als ein spezifisches
Zeichen für ein MS-Syndrom zu werten, beide Erscheinungen
sind nur als Zeichen eines chronisch-entzündlichen
ZNS-Prozesses vom Autoimmuntyp einzustufen. Die aber keine
Ausage darüber geben wie akut der Prozess ist.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MRZ-Reaktions-Viren
näher betrachtet:
|
|
|
|
|
|
Als
alleinige Auslöser des MS-Syndroms scheinen die Viren
(z.B. MRZ-Reaktions-Viren) aber
nicht in Frage zu kommen, da ihr Vorkommen (Endemiegebiete)
und die Erkrankungsrate (Prävalenz)
nicht unbedingt an bestimmte Regionen gebunden ist, sondern
alle mehr oder weniger weltweit vorkommen. Ob gemäßigte
oder nicht gemäßigte Zonen, das macht bei ihnen kaum
ein Unterschied. Betrachten wir doch mal die MRZ-Reaktions-Viren
im einzelnen näher, denen man unter den Infektionskrankheiten
bisher die größte Bedeutung in Zusammenhang mit dem
MS-Syndrom zuspricht.
|
|
|
|
|
|
MRZ-Reaktion
Þ
M [30/31]: Die
Masern kommen weltweit vor. In den Entwicklungsländern,
insbesondre Afrika gehören sie zu den 10 häufigsten
Infektionskrankheiten mit häufigen tödlichen Verlauf.
Durch konsequentes Impfen ist es gelungen die Masern in einigen
Regionen der Welt fast völlig auszurotten, z.B. auf dem
amerikanischen Kontinent. Auch in Deutschland sind die Masern,
dank 30jähriger Impfpraxis, stark zurückgegangen. So
kann man zu Masern folgendes nachlesen: Die Zahl der Masernopfer
weltweit ist dank einer Impfkampagne der WHO und der UNICEF von
1999 bis 2005 um mehr als die Hälfte gesunken. Besonders
Kinder in Afrika und Asien haben von den Impfungen profitiert
[46]. Vom Masern-Virus ist bekannt,
dass es bei Immunsupprimierten und Betroffenen mit zellulären
Immundefekten nach Außen hin leicht verläuft, nach
innen aber zu schweren Organkomplikationen führen kann.
|
|
|
|
|
|
MRZ-Reaktion
Þ
R
[30/32]:
Betrachten wir als nächstes die Röteln, dann
müssen wir auch bei ihnen feststellen das sie weltweit
endemisch vorkommen. Mit endemisch meint der Fachmann
Krankheiten, die ständig im verborgenen präsent sind und
immer wieder mehr oder weniger regelmäßig in einer
Population auftreten. Durch endemische vorkommende Erreger kommt
es allerdings i.d.R. nicht zu einer Endemie (=
Auftreten einer Krankheit in einer begrenzten Region) oder
Pandemie (= kontinentübergreifender
Ausbruch der Erkrankung). In Ländern wo nicht gegen
Röteln geimpft wird, tritt diese Erkrankung zu 80-90 % im
Kindesalter in Erscheinung. Seit 1974 wird in den alten und seit
1990 in den neuen Bundesländern das Impfen gegen die Röteln
jungen Frauen angeboten. Was dazu geführt hat das nur noch
circa bei 0,8-3 % der Frauen, zwischen 18 und 30 Jahren, Röteln
seronegativ sind.
|
|
|
|
|
|
MRZ-Reaktion
Þ
Z
[30/33]:
Zuletzt wollen wir von den MRZ-Viren das Herpes Zoster Virus
/ Varizella Zoster (VZV)
näher in Augenschein nehmen. Auch diese Viren sind
weltweit verbreitet, in Deutschland handelt es sich bei den
Varizellen um die häufigste Infektionskrankheit im
Kindesalte. Bei circa 95 % der Erwachsenen sind Antikörper
gegen VZV nachweisbar. VZV ist durch Impfung vermeidbar. Als
Erstinfektion (Primärinfektion)
treten diese Erreger als Windpocken, und als Zweitinfektion
(endogen Reinfektion) als Gürtelrose
in Erscheinung. Die VZV-Erreger breiten sich i.d.R. vom
Exanthem ausgehend, über Nerven, den sogenannten sensible
Neuronen und spinalganglien ins ZNS aus. Im ZNS überstehen
sie lange Zeiten (persistieren)
als VZV-Genom in Neuronen und den Glia-Satelitenzellen
(siehe oben: Aufbau der Nerven des ZNS und
PNS) des Wirtes, durch Rückgang der immunologischen
Reaktionsbereitschaft (Alter, Tumoren,
Immunsuppression etc.) kann es dann zum erneuten Ausbrechen
der Viren kommen.
|
|
|
|
|
|
Wie
wir an den drei Beispielen sehen können, handelt
es sich bei den Haupt-MS-Verdachtsviren (MRZ-Viren)
insgesamt, mehr oder weniger, um weltweit verbreitete
Erreger. Teilweise sind diese Erreger sogar stärker in
Richtung Äquator (z.B. Afrika;
subtropisch, tropisch) verbreitet, was ansich eigentlich
schon dagegen spricht das sie alleinige Auslöser des
MS-Syndroms sein können, da das MS-Syndrom
hauptsächlich in den gemäßigten Zonen der Erde in
Erscheinung tritt. Auch die in manchen Ländern teilweise
hohe Zurückdrängung der MRZ-Virus-Erkrankungen, durch
Impfung, spricht eigentlich gegen diese Erreger als
Hauptverursacher des Multiplen Sklerose Syndroms (MS).
Vorallem weil Impfungen gegen die MRZ-Viren hauptsächlich
eher in den Ländern der gemäßigten Klimazonen
(Europa, Nordamerika usw.) in den
letzten Jahrzehnten vorangetrieben wurden. Dies allein hätte
eigentlich schon zum Rückgang des MS-Syndroms in den Ländern
der gemäßigten Klimazonen führen müssen, dies
ließ sich aber meines Wissens nicht beobachten.
|
|
|
|
|
|
Es
könnte aber auch sein, dass in den Regionen in Richtung
Äquator die Kindersterblichkeit unter der Bevölkerungsgruppe
höher ist, die jene Prädisposition auf ihren Zellen
trägt die für das MS-Syndrom empfänglich macht. Die
angenommene höhere Kindersterblichkeit kann in Folge dazu
geführt haben, das nur wenige von ihnen das MS-Syndrom-Alter
erreichen, und so für ein geringere Krankheitshäufigkeit
(Prävalenz) in diesen Ländern
sorgen. Der Umstand könnte dann in Laufe der Evolution durch
Selektion dazu geführt haben, das die entsprechenden
MS-Syndrom-Prädispositionsfaktoren in diesen Regionen
generell weniger in der Bevölkerung auftreten. Ergebnis:
geringere Prävalenz des MS-Syndroms.
|
|
|
|
|
|
Soweit
zu den möglichen MS-Syndrom-Viren, die sicherlich einen
gewissen Stellenwert bei der MS-Syndrom-Entstehung inne haben,
aber meiner Meinung nach selbst nur seltener zum Ausbruch des
MS-Syndroms führen - immunologische
Schwellenwertüberschreitung plus erneuten Kontakt zu einer
dieser MRZ-Viren oder anderem Virus (z.B.
Influenza / Grippe). Ich denke eines der Hauptargumente
dafür das diese Viren nicht die eigentliche Ursache für
das MS-Syndrom sein können ist, das sie alle, ohne
Ausnahme, weltweit verbreitet sind. Dies gilt auch für
HHV6 (Erreger des Dreitagefiebers)
und dem Epstein-Barr-Virus
(EBV).
Teilweise kommen die Viren sogar in den
Ländern (Breitengraden)
häufiger vor, wo eigentlich das Multiple Sklerose
Syndrom eher seltener diagnostiziert wird. Auch die
MS-Island/Faröer-Insel-Theorie passt meiner Meinung nach
nicht zu der MRZ-These. Sollten dort alle drei Virenstämme
erst mit den Besatzungstruppen eingeschleppt worden sein? -
das halte ich für sehr unwahrscheinlich. Da schätze ich
die Chlamydia-pneumoniae-MS-Theorie schon als wesentlich
wahrscheinlicher ein. Eventuell sind die MRZ-Viren für einen
primären ZNS-Befall zuständig, bereiten so den Weg für
die MS, aber der eigentliche Ausbruch kommt dann erst durch eine
Co-Infektion, wie z.B. mit Chalmydia pneumoniae oder
Borrelien zustande. Doch jetzt erst einmal zu Chlamydia
pneumoniae, bevor ich dann weiter unten zu den Borrelien
als mögliche Erreger des Multiple Sklerose Syndroms komme.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Chlamydien
- Chlamydia pneumoniae:
|
|
|
|
|
|
Bei
Chlamydia pneumoniae handelt es sich wie bei Borrelia
burgdorferi (Bb.ss. = Erreger der Lyme-Erkrankung) auch um
einen recht neu identifizierten Erreger, er wurde circa drei
Jahre später als Borrelia burgdorferi, im Jahr 1985
[47] entdeckt. Chlamydia
pneumoniae wurde recht schnell unbestritten mit akuten Infektionen
des Respirationapperates (= alle an der
Atmung beteiligte Organe) in Verbindung gebracht,
insbesondere mit [48/49]: Sinusitis
(Nasennebenhöhlenentzündung),
Otitis media (Mittelohrentzündung),
Pharyngitis (Rachenkatarrh - Entzündung
der Rachenschleimhaut), Laryngitis (Kehlkopfentzündung),
Tonsillitis (Mandelentzündung),
Bronchitis (Entzündung der
Bronchienschleimhäute) und Pneumonie
(Lungenentzündung).
|
|
|
|
|
|
Inzwischen,
nach dem Verständnis einiger krankmachender Faktoren
(Pathomechanismen) des Erregers
Chlamydia pneumoniae, wird der Erreger insbesondere mit
Arterein- und Gefäßkrankheiten in Verbindung gebracht
(siehe [H]).
Insgesamt betrachtet führen die Chlamydien, ähnlich
wie die Borrelien, auch zu einem sehr unspezifischen und
klinisch schwierigen Krankheitsbild, teilweise mit
subklinischen (ohne Symptome)
oder latenten (schlafenden)
Verlauf. Als wahrscheinlich gilt das ein Großteil der
Bevölkerung chronisch an Chlamydien erkrankt ist [41].
Noch etwas hat das Chlamydien-Syndrom wohl mit der
Lyme-Borreliose gemeinsam, den schubförmigen Verlauf der
chronischen Erkrankung mit der Tendenz der Verschlechterung.
|
|
|
|
|
|
Doch
bei genauer Betrachtung sind beide Erkrankungen (Chlamydiae
/ low-dose-borreliosis) wohl schon klinisch an Hand der
Symptomatik zu unterscheiden, da bei der Erkrankung mit Chlamydien
Erscheinungen an den Atmungsorganen und Schleimhäuten recht
häufig immer wieder in Erscheinung treten (z:B.
Neigung zur Stirnhöhlenentzündung). Als sehr
schwierig ist die Klinik (Symptomatik)
sicherlich bei einer Chlamydien und Borrelien-Mischinfektion
einzustufen, verschwommene Überschneidung der Symptome
(z.B. Gelenk-, Muskelschmerzen usw.).
Obwohl in der Behandlung wohl kaum ein Unterschied besteht, da
beide Erkrankungen im chronischen, autoimmunen Stadium wohl einer
ähnlich intensiven Behandlung bedürfen wie z.B.
Tuberkulose. Chlamydien sind als obligat intrazelluläre
(= unbedingt zur Vermehrung notwendig),
und Borrelien als opportunistisch intrazelluläre (=
nur als Nische bzw. Versteck nutzend) Erreger einzustufen.
Um diese Krankheitskeime in allen Stadien der Ruhe (Latent),
in ihren Zell-Nischen (Versteck- u.
Vermehrungsort) sowie als frei beweglichen Formen zu
erreichen, bedarf es sicherlich einer entsprechend langen
Antibiose (siehe [J]).
Unter günstigen Umständen, in der entsprechenden
Phasen, können die Erkrankungen (Chlamydiae
u. low-dose-borreliosis) eventuell auch mit einer
kürzeren Antibiose zum Stillstand gebracht werden
(latenter Verlauf). Es muss dann
aber wohl unter entsprechenden Lebensumständen (neuer
viraler Infekt, Immunsuppression, Stress etc.) mit einen
erneuten Ausbruch (Schub)
gerechnet werden.
|
|
|
|
|
|
Zu
der These das Chlamydia pneumoniae einer der Erreger
des MS-Syndroms sein könne, beruht darauf das diese sich in
die Mikro-Blutgefäße (Kappilaren
[K]) des Infizierten
zurückziehen und dort zu schubförmigen Entzündungen
(episodische Vaskulitis) führen
können. Die örtlichen Entzündungen führen
in der Folge zu winzigen Löchern in den Wänden der
Mikro-Blutgefäße, wodurch dann Blut-Bestandteile
in den umliegenden Geweberaum eindringen können [41]
(Frage Autor: ist hier ein Zusammenhang zu
L-Form Borrelien - Reaktivierung der zystischen degenerierten
Borrelien im ZNS ?).
|
|
|
|
|
|
Um
im menschlich Körper fortbestehen (persistieren)
zu können befällt Chlamydia pneumoniae
Freßzellen (Monozyten, Untergruppe
der Makrophagen [Q]) die
eigentlich der Immunabwehr dienen, mit ihnen gelingt Chlamydia
pneumoniae dann das Einwandern in die sogenannte glatte
Muskulatur der Gefäßwände [44]
(Monozyten siehe Seite: Immunorgane /
Disposition / Kreuzreaktion). Die Infektion mit Chlamydia
pneumoniae der endothelen Zellen (Auskleidungszellen
der Gefäße [K])
führt bei ihnen zur Sekretion eines löslichen
Faktors, welcher auf die glatten Muskulzellen
proliferationsfördernd (= Wucherung
oder Sprossung) wirkt. Die Folge ist vermutlich eine
Verdickung der Intima (innerste Gefäßhaut)
in den entsprechenden infizierten und entzündeten Bereichen,
die zusammen mit angehäuft auftretenden sogenannten
Schaumzellen (Form d. Makrophagen [Q]
/ engl. fatty streaks) zu den Artherosklerose-typischen
Plaques in den Gefäßen führen. In Versuchen mit
menschlichen Zellen (Makrophagen)
konnte in Zusammenhang mit einer Chlamydien-Infektion die
sogenannten Schaumzellen (Form der
Makrophagen) deutlich häufiger beobachtet werden. Aus
diesem Grund wird Chlamydia pneumoniae auch mit
Atherosklerose in Verbindung gebracht [48].
|
|
|
|
|
|
Die
Chlamydien sind unbewegliche, gramnegative (=
Anfärbverhalten [L])
Bakterien deren Zellwand keine Peptidoglykanschicht [L]
enthält [44]. Die Chlamydien
werden den Mycoplasmen zugeordnet, hierbei handelt es sich
um die kleinsten selbstständig vermehrungsfähigen
Bakterien aus der Klasse der Mollicutes. Zu dieser Klasse
werden folgende Gattungen gezählt: Acholeplasma,
Anaeroplasma, Asteroleplasma, Mycoplasma,
Spiroplasma und Ureaplasma - dies nur zur
Vollständigkeit. Die Chlamydien sind selbst
nicht zur sogenannten ATP-Synthese [M]
fähig, weswegen sie auf fremde Hilfe angewiesen sind. Aus
vorgenannten Grund sind sie auf das Überleben in
den Zellen des Wirtes angewiesen (=
obligat intrazellulär). Es gibt somit zwei
Formen der Chlamydien - außerhalb der
Wirtszellen (= extrazellulär z.B.
im Blutkreislauf) bilden sie sogenannte
Elementarkörperchen die infektiös sind und innerhalb
(= intrazellulär z.B. in Monozyten)
der Wirtszellen bestehen sie als sogenannte Retikularteilchen
die nicht infektiös sind [44].
Durch diese Zwei-Form-Überlebensstrategie entziehen sich
die Chlamydien in den entsprechenden Phasen bestimmten
Immunabwehrmechanismen, z.B. als Retikularteilchen der
Phagozytose (Freßzellen, Makrophagen)
und der humoralen Abwehr (Komplementsystem -
angeborene Immunität) [44].
|
|
|
|
|
|
In
den befallenen Zellen greifen Chlamydien in das sogenannte
Apoptose-System der Wirtszellen ein. Das Wort Apoptose ist dem
Altgriechischen entliehen und bedeutet soviel wie “Wegfallen“,
im medizinischen bzw. immunologischen Sinn ist hiermit
der Selbstmord-Regelkreis der Zellen gemeint. Das heißt,
es ist eine Beschreibung dafür das sich der Organismus in
geregelter Bahn sich gealterten Teilen seiner Selbst entledigt.
|
|
|
|
|
|
Chlamydien
steuern das Apoptose-System (Selbstmord-Regelkreis)
wahrscheinlich ganz so wie sie die Wirtszellen zur eigenen
Vermehrung und zum Schutz vor der Immunabwehr benötigen
(siehe auch [J]).
Ein ähnliches Eingreifen in den Apoptose-Regelkreis ist
bisher auch insbesondere von humanen Herpes Viren (HHV)
bekannt, vom Herpes-Simplex-Virus (Typ
1 u. 2 / HHV1 u. 2), Varicella-Zoster-Virus (VZV
o. HHV3), Epstein-Barr-Virus (EBV
o. HHV4), Cytomegalievirus (CVM
o. HHV5) sowie vom Adenovirus Typ5 und Toxoplasma
gondii Erreger [52]. Allerdings
tragen diese Viren Gene in sich, die direkt in das Apoptose-System
der Wirtszellen eingreifen und auf diese Weise den
Selbstmord-Regelkreis blockieren. Chlamidia pneumoniae
hingegen greift auf verschiedenen Ebenen in den
Apoptose-Regelkreis ein. Auf der intrazellulären
Ebene, der sogenannten Mitochondrien-vermittelten Apoptose [M]
(Cytochrom c-Freisetzung und der
nachgeschalteten Caspasenentwicklung) und auf der
Ebene der extrazellulär vermittelten Apoptose (von
außerhalb der Zelle) durch Unterdrückung des als
CD95-Rezeptor [O] bezeichneten
Signalemfängers [52]. Die
extrazellulär vermittelte Apoptose wird i.d.R. durch das
sogenannten CD95-Signal, als auch mittels Tumornekrosefaktor (TNF)
ausgelöst. Im Immunsystem spielt das Apoptose-System
insofern eine große Rolle, da hiermit während der
T-Lymphozyten-Reifung (T-Zellen)
potentielle autoreaktive Thymozyten (T-Zellen)
eliminiert werden [52] (ist
hier auch ein Zusammenhang zu Borrelien? Autoreaktive T-Zellen
direkt durch Borrelien aktiviert - siehe Seite: Merkblatt, Kap.:
Was
machen mit der entfernten Zecke?).
|
|
|
|
|
|
Den
verschiedenen Chlamydien wurden bisher eine
unterschiedliche Einflussnahme auf das Apoptose-System
nachgewiesen [52]: Chlamydia
psittaci induziert die Apoptose von Epithelzellen und
Makrophagen, Chlamydia trachomatis wirkt
Apoptoseinduzierend (auslösend)
aber auch -inhibierend (unterdrückend),
Chlamydia pneumoniae wirkt in erster Linie
Apoptoseinhibierend (Selbstmord-unterdrückend)
auf die entsprechenden Zellen (Makrophagen
bzw. Monozyten und Epithelzellen).
|
|
|
|
|
|
Weiter
unterdrückt Chlamydia pneumoniae wahrscheinlich die
MHC-Klasse-1 Moleküle (siehe
Merkblatt: HLA-Faktor / Punkt 44) der befallenen Zellen
[44]. Die Körpereigenkodierung
der MHC-Klasse 1 kommt auf allen Körperzellen vor, die
MHC-Klasse 2 dagegen nur auf den Immunzellen. Die
MHC-Klasse-Faktoren sind im weiteren Sinn ein Schutz gegen den
Angriff von Immunzellen (z.B. T-Zellen),
durch eine Unterdrückung dieser Selbstkennzeichnung könnte
es eventuell zu Angriffen gegen Selbst (körpereigene
Zellen) kommen.
|
|
|
|
|
|
Immunstress
(INF-g,
essentieller Nährstoffentzug und einige Antibiotika [J])
können das Fortbestehen (Persistenz)
der Chlamydien begünstigen bzw. überhaupt
erst initiieren. Das Cytokin Interferon Gamma (IFN-g)
lässt z.B. den Zelleinschuss (nicht
infektiöses Retikularkörperchen) nicht wieder
freisetzen, eine Chlamydia-Neubildung (infektiöses
Elementarkörperchen) unterbleibt vorerst. Die
intrazellulären Retikularkörperchen nehmen eine von der
normalen Form abweichende Variante (=
aberrante Form) in der Wirtszelle ein, und das Absterben
(Apoptose) der Zelle unterbleibt
[44/52]. Die persistierenden
Chlamydien lassen sich unter diesen Bedingungen auch
nicht mehr anzüchten - ein Direktnachweis im
Labor gelingt nicht. Die aberranten Chalmydien
setzen in diesem Stadium aber immer noch bakterientypische Stoffe,
wie HSPs (cHSP-60) und Lipopolysaccharide (cLPS)
frei [44]. Unter normalen
immunologischen Umständen geschieht die Umwandlung von der
intrazellulären Version (Retikularkörperchen),
zur infektiösen extrazellulären Variante
(Elementarkörperchen), innerhalb
von 48-72 Stunden [48].
|
|
|
|
|
|
Der
zuvor oben beschriebene vaskulitische Effekt
(Entzündung der Gefäße)
kann direkt in den Gefäßen der Netzhaut (Retina)
des Auges bei einer Chlamydien-Infektion beobachtet
werden [41], man spricht dann von
einer Retinalen-Vaskulitis. Die Netzhaut (Retina)
ist die innere Auskleidung des Auges, auf der sich die
lichtempfindlichen Stäbchen und Farbempfindlichen Zapfen
befinden. Der Aufbau der Netzhaut ähnelt vom Aufbau
her im Prinzip dem Gehirn (ZNS), da sie neben den
Sinneszellen vorallem Ganglien- (Nerven)
und Stützzellen (Oligodendrozyten)
enthält. In den entzündeten Bereichen des Auges
kommt es dann in Folge zum Angriff durch T-Zellen, ein ähnlicher
krankhafter Prozess findet innerhalb des Gehirns auch an und um
den kleinen Blut-Gefäßen statt [41].
Da Retinale-Vaskulitis bei circa 40 Prozent der
MS-Syndrom-Patienten als eines der frühsten Zeichen des
Multiple Sklerose Syndroms beobachtet werden kann, hat dies dazu
geführt das einige Fachleute eine Chlamydien-Infektion
mit dem MS-Syndrom in Verbindung bringen [41].
Weiter konnte beobachten werden, dass die frühsten
krankhaften Erscheinungen (pathologischen
Manifestationen) beim MS-Syndrom im allgemeinen an den
Blutgefäßen auftreten, nicht an den Nerven und
Glia-Zellen. Auch dies lässt einige Fachleute die These
vertreten das der Myelinverlust (Isolierung
der Nerven) eher ein sekundäres Phänomen beim
MS-Syndrom darstellt [41].
|
|
|
|
|
|
Auch
soll das häufigste Ausbruchsalter des MS-Syndroms ungefähr
mit dem Alter übereinstimmen, in dem es zur Serokonversion
von Chlamydia pneumoniae kommt. Hiermit ist gemeint, das es
in diesem Alter bei vielen Individuen zur Veränderung des
Antikörpergehaltes (AK-Gehalt)
im Serum kommt - sprich, es geschieht bei vielen dieser
Altersklasse ein Umschwenken von Chlamydia pneumoniae
Serum-AK-negativ zu Serum-AK-positiv. Weiterhin sollen neue
Chlamydia pneumoniae Atemwegsinfektionen mit
MS-Syndrom-Rückfällen (neue
MS-Syndrom-Schüben) in Verbindung gebracht werden
können. Die Tatsache das eine fortbestehende
(persistierende)
Chlamydia-pneumoniae-Erkrankung eine
intracerebrale-Infektion darstellen (hinter
der Blut-Hirnschranke) kann, dort ein allgemeiner Schutz
vorm Blutkreislauf besteht, macht es recht unwahrscheinlich das
man einen hohen Chlamydia pneumoniae Antikörpergehalt
im Serum des Patienten antrifft - ähnlich wie bei
Neuro-Borreliose. Hingegen soll bei 64 Prozent der
MS-Syndrom-Patienten das Hirnwasser Chlamydia pneumoniae
Antikörper-positiv sein (Liquordiagnostik),
mittels PCR-Technik (Erbgutnachweis)
soll der Positivnachweis sogar bei 94 Prozent gelingen
(Vanderbilt-Studie 1999). Es gibt
aber auch Studien mit anderen Ergebnis, so z.B. eine der
Universität Heidelberg. In der Heidelberger Studie konnte nur
bei rund einem Viertel der MS-Fälle, mittels PCR-Technik, ein
positiver Chlamydia pneunomiae Befund gestellt werden. Dies
führte bei den Forschern zu der Ansicht, das eine
Chlamydien-Infektion wahrscheinlich nur bei einer Subgruppe
von MS-Patienten eine Rolle spielt [47].
Da es sich bei einer persistierenden Chlamydia pneumoniae
Erkrankung um eine intracerebrale-Infektion handeln kann, soll die
Serologie im allgemeinen notorisch schwierig zu interpretieren
sein [41]. Auch die Anzucht
von Chlamydia pneumoniae soll nur sehr schwer gelingen
[45] (siehe
auch oben: Immunstress) und das PCR-Nachweisverfahren
stufen einige Experten als zu Empfindlich ein, es soll leicht
durch abgestorbene Erreger zu einem falsch positiven Befund führen
[48]. Beim RKI (Robert-Koch-Institut
[45])
kann man bzgl. PCR-Nachwisverfahren lesen: der
molekularbiologische Nachweis mittels PCR ist speziesspezifisch
und potentiell hoch sensitiv, allerdings gibt es noch keinen
kommerziellen Test, die Chlamydien-PCR ist bisher
(Stand 2001) nur in
Speziallaboratorien etabliert [45].
|
|
|
|
|
|
Chlamydien
besitzen gattungsspezifische und speziesspezifische AG
(Antigene). Die gattungsspezifischen
AG sind Lipopolysacharide (LPS) der Zellwand sowie
Hitze-Schock-Proteine (HSPs) und befinden sich im
Größenbereich von 60 u. 70 kD, und die
spziesspezifischen AG von Chlamydia pneumoniae befinden
sich im 53 u. 98 kD-Bereich. Die Immunreaktion auf die
gattungsspezifischen AG sollen mittels Komplementbindungsreaktion
(KBR) nachweisbar sein, und die
speziespezifischen Antikörperreaktion (IgM-,
IgG- und IgA-AK) im Mikro-Immun-Fluoreszenztest (MIF)
[45/48]. Antigen-Nachweisverfahren
(IFT, ELISA etc.) sollen wegen ihrer
zu geringen Sensitivität und Spezifität nicht zu
empfehlen sein [45].
Primärinfektionen mit Chlamydia pneumoniae sollen nur
einen partiellen bzw. zeitlich befristeten Schutz vor
Reinfektionen bieten, so soll es bei einer Reinfektion zu keiner
IgM-Reaktion kommen, nur zu einem raschen Anstieg von IgG- u.
IgA-AK [45/48]. Eine
persistierende Infektion mit Chlamydia pneumoniae soll zu
einem ständig erhöhten IgA-Spiegel führen [41].
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Eigenschaften
von Chlamydia pneumoniae kurz zusammengefasst:
|
|
|
|
|
|
·
Die infektiösen Chlamydien (sog.
Elementarteilchen) befallen Makrophagen (Monozyten)
und wandern mit ihnen in die Endothelzellen der Blut-Gefäße
ein, dort Überleben sie vor der Immunabwehr geschützt in
abgewandelter, nicht infektiöser Form als sogenannte
Retikularteilchen.
|
|
|
|
|
|
·
Zum Überleben nutzen die
Chlamydia-Retikularteilchen die Energie (ATP-Synthese)
der Wirtszelle und nehmen auf deren Adoptose
(Selbstmord-Regelkreis) zu ihren
Gunsten Einfluss, um sich bei besseren Umgebungsbedingungen zu
vermehren.
|
|
|
|
|
|
·
Der intrazelluläre Befall der endothelen Zellen
führt bei den betroffenen Zellen zur Sekretion eines
löslichen Faktors, welcher die glatten Muskelzellen zur
Wucherung und Sprossung anregt - Folge: Verdickung und Verhärtung
der innersten Gefäßhaut (Intima).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MS-Syndrom
begünstigende Faktoren von Chlamydia pneumoniae:
|
|
|
|
|
|
·
Der intrazelluläre Befall der Endothlezellen
führt zu Entzündungen der betroffenen Gefäßbereiche,
hierdurch vielleicht Aufweichung der Blut-Hirn-Schranke - Folge:
es können eventuell leichter autoreaktiv ausgerichtete
Immunzellen (z.B. T-Zellen) und
Antikörper ins Gehirn und Rückenmark (ZNS)
einwandern.
|
|
|
|
|
|
·
Kontakt der Immunzellen mit Körpergeweben die
ihnen bis dahin verborgen waren, z.B. mit sogenannten
ontogenetischen Gewebe (entstanden nach der
Ausbildung der Selbsttoleranz) oder sequestrierten
Proteinen (isolierte Proteine).
Denkbar ist dies in unserem Fall der Chlamydien-Infektion
vorallem durch die Schädigung der Gefäßen in der
Netzhaut der Augen (Retinalen-Vaskulitis).
Der Aufbau der Netzhaut (Retina)
ähnelt im Prinzip dem des Gehirns (ZNS),
da sie neben den Sinneszellen vorallem Ganglien- (Nerven)
und Stützzellen (Oligodendrozyten)
enthält - hierdurch eventuelle autoreaktive Fehlausrichtung
von Immunzellen.
|
|
|
|
|
|
·
Vermutlich kommt es in Folge einer
Chlamydien-Infektion zur Unterdrücken der
Körpereigenkodierung (MHC-Faktor 1)
auf der Oberflächen der befallenen Zellen, so das die
Immunabwehr die körpereigenen Zellen eventuell als feindlich
einstuft und angreift.
|
|
|
|
|
|
|
|
|
|
|
|
Meiner
Meinung (A. Hartwig) nach sind dies
aber keineswegs Prozesse die direkt zur autoreaktiven Ausrichtung
der Immunabwehr (z.B. T-Zellen, Antikörper
etc.) führen, sonder vielmehr Faktoren die eventuell
eine Brücke schlagen (vergl. im Militär
mit Pionieren), so das eine andersartig (z.B.
durch Viren o. Borrelien) fehlausgerichtete Immunabwehr
(vergl. im Militär z.B. Panzern)
leichter ins ZNS einwandern kann. Somit bekleiden die Chlamydien
sicherlich einen stark MS-Syndrom begünstigenden Posten, aber
das die Chlamydien allein zum MS-Syndrom führen glaube ich
eher weniger. Auch einige im nachfolgenden Absatz aufgeführt
Fakten sprechen meiner Meinung nach eher dafür, dass die
Chlamydien nicht die Hauptauslöser des MS-Syndroms
sein können.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die
Verbreitung von Chlamydia pneumoniae ein Argument dagegen
das sie Hauptauslöser der MS sind?
|
|
|
|
|
|
Als
Wirt (Erregerreservoir) für
Chlamydia pneumoniae ist bisher nur der Mensch bekannt
- allerdings gibt es Subspezies (z.B.
Chlamydia pneumoniae biovare) die bei Pferden, Koalas und
Fröschen nachgewiesen worden sind, die bisher aber für
den Menschen als weniger von Bedeutung eingestuft werden [45].
Bisher bekannte Infektionswege sind Tröpcheninfektion
(aerogener Weg) und
Speichelkontakt von Mensch zu Mensch [45]
(z.B. Intimkontakt durch Küssen).
Beim Übertragungsweg kommen wir auch zum Vorkommen
(Verbreitung u. Endemiegebiete) und
zur Prävalenz (Erkrankungs- bzw.
Infektionsrate) von Chlamydia pneumoniae, dessen
Daten mich zu der Ansicht führen das Chlamydien in
erster Linie nur Wegbereiter für das MS-Syndrom sind (bzw.
sein können) selbst aber eher weniger für die
Autoimmunreaktion verantwortlich sind. Für die eigentlichen
autoreaktive Reaktion sind nach meiner Meinung dann z.B. Viren
(z.B. MRZ-Viren, EBV etc.) oder aber
vorallem Borrelien (Bb.sl.-Komplex)
verantwortlich. Die Chlamydien weichen die
Blut-Hirnschranke auf (Primär-Erkrankung),
so das in Folge (Sekundär-Erkrankung)
leichter autoreaktive Immunzellen und Antikörper ins ZNS
eindringen können.
|
|
|
|
|
|
Beispiel:
die Chlamydien möchte ich mit Wühlmäusen
vergleichen, die in klimatisch ruhigeren Zeiten den Deich an der
Küste durchlöchern und auf diese Weise beschädigen.
Kommte es zu keiner Sturmflut, bei mein Beispiel gleichzusetzen
mit einer entsprechenden Viren oder Borrelieninfektion, wird man
dem Deich die Schäden weniger ansehen. Der Deich macht bei
wenig genauer Betrachtung für den Laien einen guten und
heilen Eindruck, gleichzusetzen mit einer subklinischen (ohne
offensichtlicher Symptome) oder latenten (ruhend
bzw. schlafend) Chlamydien-Infektion. Kommt eine
Unwetterereignis hinzu, z.B. eine Sturmflut (=
entsprechende Viren oder Borrelien-Infektion), kann
das Wasser leichter durch die vorgeschädigten Bereiche
(löchrigen Blutgefäße)
in das Hinterland strömen (=
autoreaktive Antikörper und Immunzellen) und für
Verwüstung (= Entzündungs- und
Entmarkungsherde im ZNS) sorgen. Im schlimmsten Fall kommt
es gar zum Dammbruch (=
Blut-Hirnschrankenstörung mit oligoklonalen Bandennachweis).
Soweit mein kleines Beispiel zum bessern Verständnis.
|
|
|
|
|
|
Doch
jetzt zurück zur Prävalenz und Verbreitung von
Chlamydia pneumoniae. Chlymidia pneumoniae soll
jahreszeitlich unabhängig auftreten und weltweit verbreitet
sein, die Infektiosität wird allerdings mit niedrig
angegeben [48]. Die Höhe der
Weltdurchseuchung der Erwachsenen wird im Schnitt mit 40 Prozent
angegeben, in tropischen Breiten (z.B.
Teiwan) allerdings mit 75 Prozent deutlich höher
als in den gemäßigten Breiten (z.B.
Skandinavien: 45 %). Eine Erstinfektion (Primärinfektion)
geschieht meist in der Zeit zwischen 5. und 14. Lebensjahr (z.B.
USA, Skandinavien usw.), und im späteren Leben soll es
zu häufigen Reinfektionen kommen [44].
Der steilste Prävalenzanstieg wird für die
Lebensjahre zwischen 15. und 19. Lebensjahr verzeichnet [48],
was wohl an einen der Übertragungswege liegt (Küssen
bzw. Speichelkontakt). Im hohen Alter (70.
Lebensjahr) sollen circa 70-100 Prozent
Chlamidia pneumoniae Antikörpertiter positiv sein
(70-80 % der Frauen / 80-100% der Männer),
was im Prinzip Mehrfachinfektionen im Leben bestätigt
[48/49].
Die Neuinfektionsrate wird auf 1-2 Prozent angegeben, für
Deutschland bedeuten dies in etwa das sich pro Jahr circa 1,5-3
Mio. neu infizieren [49]. 15 Prozent
der ambulant erworbenen Lungenentzündungen sollen auf
Chlamydia pneumoniae zurückgehen [48],
allerdings soll der Erkrankungsverlauf bei 70-90 Prozent der
Infizierten asymptomatisch sein [49].
Meiner Meinung nach sprechen auch diese Daten
(Verbreitungs- und Infektionsdaten)
dagegen das Chlamydia pneumoniae als der eigentliche
(Haupt)-Erreger des MS-Syndroms in Frage kommt, ich denke bei
den Borrelien (insbesondere des
Bb.sl.-Komplex) sieht es hingegen anders aus, sie
vereinen wesentlich mehr Eigenschaften (jahrezeitliches
Auftreten, Verbreitung, etc.) die in Zusammenhang mit
dem MS-Syndrom stehen können.
|
|
|
|
|
|
Meine
These:
|
|
|
|
|
|
Eine
solitäre Infektion mit Chlamydia führt zur
>>wahrscheinlichen MS-Syndrom-Bereitschaft<< und eine
ebenso solitäre Infektion mit Borrelien zur >>mäßig
wahrscheinlichen MS-Syndrom-Bereitschaft<< aber erst eine
Co-Infektion mit beiden Erregerklassen (Primär-
u. Sekundär-Erreger) führt zur >>erhöhten
MS-Syndrom-Bereitschaft<<. Kommt noch eine Prädisposition
(erbliche Veranlagung) hinzu, führt
dies meiner Meinung nach zur >>sehr starken
MS-Syndrom-Bereitschaft<<
|
|
|
|
|
|
In
Alarmstufen ausgedrückt:
|
|
|
|
|
|
Alarmstufe
1: solitäre Chlamydien-, Borrelien- oder
entsprechende Virusinfektion (z.B. EBV,
MRZ-Viren etc.)
|
|
|
|
|
|
Alarmstufe
2: Co-Infektion mit Chlamydien und Borrelien
|
|
|
|
|
|
Alarmstufe
3: Co-Infektion mit Chlamydien, Borrelien und
entsprechender akuter oder chronischer Virusinfektion (z.B.
EBV, MRZ-Viren etc.)
|
|
|
|
|
|
Alarmstufe
4: Co-Infektion mit Chlamydien und Borrelien sowie
vorliegender Prädisposition
|
|
|
|
|
|
Alarmstufe
5: Prädisposition zusammen mit einer Chlamydien und
Viren Co-Infektion (z.B. EBV, MRZ-Viren
etc.) oder mit einer Borrelien und Viren Co-Infektion
|
|
|
|
|
|
Alarmstufe
6: Co-Infektion mit Chlamydien, Borrelien und
entsprechender akuter oder chronischer Vireninfektion (z.B.
EBV, MRZ-Viren etc.) sowie vorliegende Prädisposition
|
|
|
|
|
|
|
|
|
|
|
|
Modellvorstellung
über das Gefährdungspotential am MS-Syndrom zu erkranken
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die Borrelien
(insbs. Bb.sl.-Komplex) mögliche Haupterreger des
MS-Syndroms?
|
|
|
|
|
|
Ich
möchte in diesen Kapitel meiner Homepage nicht nochmals
in allen Einzelheiten auf die krankmachenden Eigenschaften
(Pathomechanismen) der Borrelien
eingehen, nur soweit wie es sich vermutlich um
MS-Syndrom auslösende Prozesse handelt oder aber von
der Datenerhebung einen wahrscheinlichen Zusammenhang aufzeigen
könnte.
|
|
|
|
|
|
In
ca. 40-60 Prozent (Schnitt 50 % [85])
der Fälle verläuft das Infektionsschema bei der
Lyme-Borreliose mit Borrelia burgdorferi
(Bb.sl.-Komplex) wohl wie
nachfolgend beschrieben ab. Kommt es beim Eindringen der
Borrelien in den Körper des Wirtes (Infektion)
zum Kontakt zu dendritischen Zellen, gelingt es diesen
Zellen die Borrelien entsprechend immunologisch
aufzuarbeiten, dann kommunizieren diese mittels chemischen
Botenstoffen mit T-Lymphozyten (T-Zellen)
in ihrer Nachbarschaft. Bei diesen chemischen Botenstoff handelt
es sich um das Zytokin Interleukin 23 (IL-23),
welches wiederum die T-Zellen zur Ausschüttung von
Interleukin 17 (IL-17) anregt.
Hierdurch wird im Verlauf der Infektion mit Borrelia
burgdorferi unter den entsprechenden Immunzellen eine
Informationskaskade in Gang gesetzt, welche letztendlich zur
Entzündung von bestimmten Organen wie Gelenke, Herz und
Gehirn führt [83] - siehe
hierzu auch die Seite “Merkblatt“, Abs.
“Tarnstrategien“.
|
|
|
|
|
|
Der
Kontakt zwischen den dendritischen Zellen (DC)
und den Borrelien dürfte recht häufig
geschehen (Kennzeichen vermutl. die
Wanderröte / EM), da die DC-Zellen sich im
unreifen Zustand im sogenannten nicht lymphoiden Gewebe
befinden - so auch im Gewebe der Haut, dem
Eintrittsort der Borrelien in den Körper des Wirtes
(z.B. Mensch). Sie sind somit
Immunzellen an vorderster Front gegen von außen durch die
Haut eindringende Keime, also die ersten Zelltypen die fremdes
Material (Antigene / AG) umschließen,
in sich aufnehmen und für den nachfolgenden immunologischen
Vorgang aufbereiten (Prozessieren).
Ihre Aufgabe ist Fremdproteine bzw.Antigene (AG)
zu erkennen und aufzunehmen, um mit ihrer AG-Fracht zu den
Lymphknoten zu wandern. In den Lymphknoten präsentieren
die DCs dann (als ausgereifte
dendritische Zellen) den T-Lymphozyten (T-Zellen)
den Steckbrief des Antigens, wodurch diese angeregt
werden, einen Vernichtungszug gegen alles zu starten was
spezifisch mit diesem Antigen versehen ist. Hierbei können
Fehler vorkommen, zumal wenn der Krankheitserreger vorrangig aus
sog. Tolergenen besteht und weniger aus Antigenen (siehe
“Merkblatt“, Abs. “Tarnstrategien“: von 11
klassifizierten Lipidfraktionnen konnte nur zweien eine antigene
Wirkung beim Menschen nachgewiesen werden).
|
|
|
|
|
|
Die
dendritischen Zellen (dendritic
cell/s = DC/s) näher betrachtet:
|
|
|
|
|
|
Die
dendritischen Zellen (DC) haben ihren
Namen da sie viele Verzweigungen und Verästelungen aufweisen,
denn “dendritus“ ist dem Lateinischen
entliehen und bedeutet “verzweigt“.
|
|
|
|
|
|
Der
Immunologe unterscheidet verschiedene Gruppen von DCs. Er
spricht von sogenannten “Follikulären DCs“,
die vorallem in den Lymphknoten (Lymphfollikel
/ Folliculi lymphatica / Noduli lymphatica) vorkommen,
der Ort wo sich die B-Lymphozyten (B-Zellen
/ im Knochenmark gereifte Zellen) differenzieren und teilen
(vermehren) sowie
Makrophagen-Ansammlungen anwesend sind. Von sogenannten
“Interdigitierenden DCs“, die dem Knochenmark
entstamme. Ihr Vorkommen verteilt sich über den gesamten
Körper, z.B. der Milz, im Thymus, den Tonsillen (z.B.
Gaumenmandeln) sowie in den Peyer-Plaques
(Lymphfollikeln-Ansammlungen im Dünndarm)
und vorallem dort wo T-Lymphozyten (T-Zellen)
vorkommen. Bei den DCs die in der Haut und den
Schleimhäuten ansäßig sind, spricht man von
“Langerhans-Zellen“. Die “Langerhans-DCs“
kommen dort vorallem in der zweit-untersten Schicht,
der sogenannten Stachelzellschicht (Stratum
spinosum) in der Oberhaut (Epidermis)
vor. Sie befinden sich dort quasi in Warte-Position bis sie
Kontakt zu einem Antigen bekommen, das sie in sich aufnehmen
(Phagozytose), wodurch sie in Folge
zu Antigen-präsentierende Zellen heranreifen. Die
“Follikulären-“ und “Langerhans-DCs“
interagieren sehr stark mit T-Lymphozyten (T-Zellen).
|
|
|
|
|
|
Die
DCs haben eine wesentliche Rolle in Bezug auf die T-Zellen inne,
die fälschlicher Weise ein Selbst-Antigen als Fremd
betrachten, also autoreaktiv sind. Diese gegen
das “Selbst“-Antigen gerichteten T-Zellen
können von den DCs quasi deaktiviert werden, das
Immunsystem wird somit gezielt abgeschaltet - Immunologen
sprechen bei dieser selektiven Abschaltung gegenüber einem
Antigen von Anergie.
|
|
|
|
|
|
Die
DCs gelten in der Immunologie als sehr einflussreiche
Antigen-präsentierende Zellen, welche vorrangig eine
sogenannte zytotoxische T-Zellantwort anregen. Unter
zytotoxische Zellen versteht man sogenannte immunkompetente
Zellen, die ohne Komplement (angeborene
unspezifische hormorale Immunität) über
direkten Kontakt zur Zytolyse (töten
durch Auflösung mittels sog. Lymphokine) der
entsprechend mit dem Antigen (zelleigen
und -fremd) versehenen Zellen führt. Zu den
zytotoxischen Zellen gehören vorallem entsprechend aktivierte
T-Lymphozyten (T-Zellen = im Thymus gereifte
Zellen). Nachdem die DCs Antigene (AG)
wie Mikroorganismen (z.B. Borrelien),
Antigen-Antikörperkomplexe, apoptische und nekrotische Zellen
aufgenommen haben, präsentieren sie diese
sehr effizient anderen Immunzellen zusammen mit den
MHC-Faktoren der Klasse 1 und 2. Die MHC-Faktoren dienen
der Unterscheidung zwischen “Selbst“ und “Fremd“
bei der Aktivierung von spezifischen Immunzellen (MHC-Faktor
1 u. 2 siehe “Merkblatt“, Punkt 44 / HLA-Faktor).
Mit der Aufnahme des Antigens beginnen die unreifen DCs
an zu reifen und schütten hierbei verschiedene
chemische Botenstoffe aus, wodurch andere Immunzellen zum Ort
des Geschehens gelockt werden. Doch die eigentliche
Aufgabe der DCs ist die spezifische Immunabwehr (T-Zellen)
auf das entsprechende Antigen auszurichten und zu aktivieren,
was in den benachbarten Lymphknoten des Infektionsortes (bzw.
Einnistungsort des Erregers, Nische) geschieht. Erfolgt
dieser doch sehr örtlich begrenzte spezifisch
ausgerichtete immunologische Vorgang fernab von dem
Erreger-ähnlichen Gewebe (Prädispositions-Faktoren
des Wirtes), werden sich die spezifisch
ausgerichteten zytotoxischen Immunzellen (T-Zellen)
auch nicht gegen das ähnliche Gewebe richten da sie
den chemischen Lockstoffen zum Ort der Infektion, weit weg von
dem entsprechenden ähnlichen Gewebe, folgen. Auch
in der Folge gebildete Antikörper (AK)
würden sich somit nur an die Krankheitsereger
heften, somit weitere Immunzellen vorrangig nur zum Ort der
Infektion locken (z.B. Unterhaut).
Geschieht dieser Vorgang aber nahe am Prädispositions-Gewebe,
z.B. bei der Borreliose in den Mikrogefäßen der
Augen oder dem Gehirn, kann es dort durch den zytotoxischen
Vorgang zur Aufweichung der Barrieren (z.B.
Blut-Hirn-Schranke) kommen, wodurch dann auch Antikörper
(AK) in die
Prädispositions-Bereiche gelangen können wo sie sich
dann auch an das dem Krankheitserreger ähnliche Gewebe
(bzw. Zellen) anlagern werden.
Die fatale Folge, es werden weitere Immunzellen
dort hingelockt, so auch sogenannte AK-abhängige
zytotoxische Zellen (Killer- bzw.
K-Lymphozyten, Monozyten u. Makrophagen). Diese
AK-abhängigen zytotoxischen Zellen (sogen.
ADCC) zerstören nur Zellen, an denen ein
entsprechender AK an der Zelloberfläche angedockt hat.
Durch Ähnlichkeiten zwischen Fremd- u. Eigenantigenen kann
dann unter entsprechenden Umständen ein
immunologischer Flächenbrand gegen “Selbst“
(z.B. der Beginn des Multiple Sklerose
Syndroms/ MS) entstehen. Da AK-abhängige
zytotoxische Zellen nur durch gebundene AK zur Zytolyse angeregt
werden, keine Restriktion durch den MHC-Faktor erfahren, kann
hierdurch ein fataler Autoimmunprozesse durch Prädisposition
gegenüber dem entsprechenden Krankheitskeim ausgelöst
werden. Zumal die dendritischen Zellen (DCs)
auch das Eiweiß Chemokin CXCL13 produzieren,
welches in starker Wechselbeziehung zu den Borrelien stehen
soll die den Wirt infiziert haben (spirochetale-Last).
Das CXCL13 soll zusammen mit IgG insbs. innerhalb des entzündeten
Gewebes im Nervensystem auftreten. Treten die beiden Faktoren
(CXCL13 u. IgG) über einen
längeren Zeitraum im entzündeten Gewebe auf, sollen sie
zusammen ein definitives Merkmal für eine Neuro-Borreliose
(Lyme-neuroborreliosis / LNB) sein
[90].
|
|
|
|
|
|
Gelangen
die Borrelien an dieser ersten Immunabwehr, den DCs
im Unterhautgewebe vorbei in den Körper des Wirtes
(z.B: Mensch), z.B. wenn die Zecke
mit ihrem Stechapperat direkt ein Blutgefäß trifft
(Kennzeichnen vermutlich. fehlende
Wanderröte / EM), fällt somit dieser
sehr effiziente Schutzwall der Immunabwehr in der Haut weg. Auf
diese Weise würden die Borrelien somit leichter in ferne
Organe gelangen (Gehirn, Herz, Gelenke
etc.), wo sie dann zu ganz anderen Immunreaktionen führen
können. Hierdurch kann dann der anfänglich örtlich
begrenzte immunologische Kampf gegen die Borrelien gefährlich
nahe an den dem Eindringling ähnlichen Gewebe
(Prädispositions-Selbsantigen)
stattfinden - z.B. in den Augen, in der Nähe von
Nerven bzw. in den Blutgefäßen des Gehirns
u./o. Rückenmarks (ZNS).
Der Beginn des MS-Syndroms, weil der Patient sich in diesem Fall
an keine Wanderröte erinnern würde? Liegt keine
Prädisposition des Patienten vor, wird man wohl anhand von
Borrelien-spezifischen Antikörpern eventuell noch,
trotz fehlender Wanderröte, serologisch die Diagnose
Borreliose stützen - Glück gehabt Patient! Liegt eine
entsprechende Prädisposition des Patienten vor, fehlen
wahrscheinlich die als Borrelien-spezifisch geltenden
Antikörper, eine Borreliose ist somit nach derzeitigen
schulmedizinischen Standart ausgeschlossen - Pech gehabt Patient,
musst wohl mit der Diagnose Multiple Sklerose Syndrom (MS)
leben!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Das
MS-Syndrom und die Nervenerkrankung Neuro-Borreliose (NB
/ C-NB) vergleichend betrachtet:
|
|
|
|
|
|
Das
MS-Syndrom und die Neuro-Borreliose haben weltweit sich zum
Großteil deckende Regionen der Verbreitung (siehe
Seite: Prävalenz bzw. Verbreitung - Borreliose / Multiple
Sklerose), mit kleinen Abweichungen, die sich dadurch
erklären können das mit hoher Wahrscheinlich nicht nur
Lyme-Borrelien (Bb.sl.-Komplex)
die alleinigen Auslöser des MS-Syndroms sind. Vielmehr
muss davon ausgegangen werden, dass auch andere Borrelien sowie
weitere Erreger wie z.B. EBV, Chlamydien etc.
(Triggereffekt) das MS-Syndrom
verursachen können. Beim MS-Syndrom und der Neuro-Borreliose
decken sich viele Symptome, z.B. bestimmte
Entzündungserscheinungen an den Nerven (PNS),
Gehirn und Rückenmark (ZNS)
inklusive Vaskuliten und der Schädigung von den Markscheiden
(z.B. Oligodendrozyten, Schwan´schen
Zellen etc.) und Axone. Das breite Spektrum der Symptome
(Krankheitszeichen) bei MS-Syndrom
und Neuro-Borreliose ähnelt sich sehr, es gibt bei beiden
Krankheitsbildern eigentlich kein Symptom das spezifisch für
die jeweilige Erkrankung (Syndrom)
ist. Das recht variable und in seinem zeitlichen Verlauf
sich stark ähnelnde Erscheinungsbild, schubförmige
Verschlechterung oder chronischer Verlauf - bei 80 % der
MS-Patienten beginnt die Erkrankung schubförmig (bedingt
durch Borrelien?) und nur bei 20 % primär
chronisch (bedingt durch andere
Erreger,z.B. EBV ?). Doch auf die sich deckende Symptomatik
vom MS-Syndrom (MS) und
Neuro-Borreliose (NB) möchte ich
hier nicht weiter eingehen, hiermit wird sich wohl schon jeder
einschlägig befasst haben der diese Seite aufsucht. Ich
möchte noch erwähnen, dass der primär chronische
MS-Beginn i.d.R. eher später erfolgt als der schubförmige
MS-Beginn. Das heißt, jugendliche oder junge Erwachsene
bekommen eher das schubförmige MS-Syndrom (Chlamydien-
u. Borrelien-Infektion ?), älter Erwachsene eher
die chronische Form (immunologische
Schwellenwertüberschreitung ?). Erklärt werden
kann dies eventuell mit den unterschiedlichen
Infektionszeitpunkten von z.B. der sogenannten Studentenkrankheit
(EBV) [4],
die wohl meist erst durch intimen Kontakt (Schleimhautkontakt,
kissing disease) im Studentenalter (>
20 Jahre) übertragen wird, und der Borreliose, mit
deren Erregern (Bb.sl.-Komplex)
schon viele Kinder und Jugendliche (< 20
Jahre) in Kontakt gekommen sein dürften. Ein Beweis
für eine recht hohe Borrelien-Infektionsrate im Alter
unter 15 Jahre wurde z.B. in Bayern erbracht [5].
Es ist auch denkbar, dass für den späteren chronischen
MS-Syndrom-Verlauf die natürliche Alterung des ZNS
mitverantwortlich ist. Bei der Gehirnalterung geschieht der
Hauptschwund nämlich nicht unter den Nervenzellen (Neuronen),
sondern vielmehr in der weißen Substanz (Isolierung
der Nerven und Stützzellen / Oligodendrozyten). Früher
hat man recht einfache Vorstellungen der Hirnalterung gehabt, doch
neuere Langzeitstudien geben einen Hinweis darauf das sie viel
komplizierter als gedacht verläuft. Auch ist die Alterung des
Gehirns sehr individuell, verläuft nicht linear und ist von
Hirnregion zu Hirnregion sehr unterschiedlich ausgeprägt [8].
|
|
|
|
|
|
Der
altersbedingte natürlich Schwund der weißen Substanz
(Markscheiden, Myelin etc.) kann
eventuell dazu führen, das die Markscheiden dünner
werden und so Entzündungen überhaupt erst klinisch durch
Symptomatik bemerkt werden. Der Motor der Entzündung/en kann
z.B. eine latente Infektion sein (z.B. EBV,
Chl. pneumoniae, Borrelien etc.), bei der die
Antigene und Antikörper sich auf recht niedrigem Level die
Waage halten. Im jugendlichem Alter würden so die noch recht
dicken Isolierungen (Markscheiden:
Oligodendrozyten, Schwan´schen Zellen) der Nerven der
schwachen chronischen Grundentzündung standhalten, erst nach
dem Einsetzen des altersbedingten Schwund der Markscheiden, würde
es dann stellenweise zur Abisolierung der Nerven kommen. Mit der
Folge der eventuellen Verselbstständigung, da mit der Zunahme
der abisolierten Stellen immer mehr Selbst-Antigene an den Nerven
freigelegt würden, die bis dahin für das Immunsystem
aller Wahrscheinlichkeit nach unsichtbar waren. Kommen die
körpereigenen Reparaturmechanismen mit dem Ausbessern nicht
mehr nach, werden die wahrnehmbaren Beschwerden (klinische
Symptome) für den Betroffenen immer stärker. Sind
die ersten Beschwerden eventuell nur ein Elektrisiergefühle
(Ameisenlaufen), so können
spätere Beschwerden starke Lebensbeeinträchtigung (z.B.
Lähmungen) bedeuten bis hin zum früher
eintretenden Tod.
|
|
|
|
|
|
Querschnitt
durch zwei Gehirne mit Entzündungsherden in der weißen
Substanz
|
|
|
|
|
|
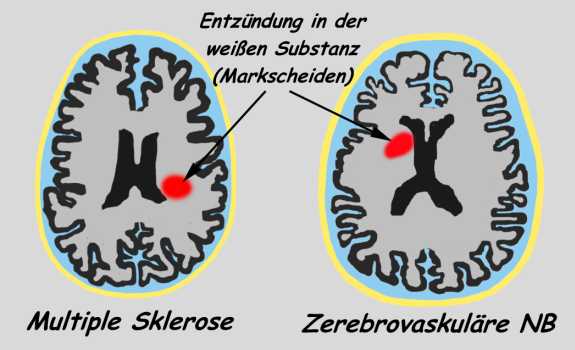
Entwurf
u. gez.: A. Hartwig nach [1], [2]
u. [3]
|
|
|
|
|
|
|
|
|
|
|
|
Die
diagnostischen, serologischen (z.B.
oligoklonale Bande) und klinische Überschneidungen
möchte ich hier nicht unerwähnt lassen, da sie dazu
führen das selbst Fachärzten (Neurologen)
häufig die letztendlich sichere Diagnose, MS-Syndrom oder
Borreliose schwer fällt. Um die Diagnoseschwierigkeiten
bei dem Multiple Sklerose (MS) Syndrom nochmals zu
veranschaulichen, möchte ich an dieser Stelle noch kurz ein
Abschnitt aus “Multiple Sklerose - Information und Ratschläge
[1] “ zitieren.
|
|
|
|
|
|
>>Daneben
können diese Borrelien aber auch im Zentralnervensystem zu
einer Entzündung führen, die sich ähnlich wie eine
MS auswirken kann (Neuroborreliose). Durch genaue Untersuchungen
des Blutes und des Liquors kann man dies jedoch meist klären.
Im Zweifelsfall ist eine Behandlung der Borreliose zu empfehlen.<<
|
|
|
|
|
|
Doch
aber genau in den genaueren Untersuchungen des Blutes und des
Liquors liegt wohl eins der Diagnoseprobleme, da es hier zu
Überschneidungen kommen kann. Das heißt, bei der
Borreliose können - alle - serologischen Marker auftreten,
die auch als Marker des Multiple Sklerose Syndroms (MS)
gelten. Findet man keine als spezifisch geltende
Borrelien-Antikörper (Bb.-AK),
wird man bei entsprechender Klinik (Symptomatik,
Entzündungsmerkmale etc.) von MS-Syndrom sprechen. Ist
die Bb.-AK-Reaktion grenzwertig, bzw. unterm Schwellenwert [B],
wird man vielleicht noch von einer möglichen Borreliose
sprechen. Ein entsprechend sensibilisierter Facharzt (Neurologe)
wird dann wohl auch eine mögliche Borreliose weiterhin im
Auge behalten. Kann man keine Antikörper nachweisen
die als spezifisch für Borrelien gelten, dafür
aber autoreaktive Antikörper (Autoimmunreaktion)
die gegen Ganglioside gerichtet sind, z.B. den sogenannten
GM1-Antikörper, wird man wohl bei entsprechender
Klinik die Diagnose MS-Syndrom stellen und womöglich
gleich mit Entzündungshemmern (z.B.
Kortison) behandeln. Wird aber ein
immunologischer Erkennungprozess unterbrochen, z.B. die nach
dem Erstkontakt neuere spezifischere Identifizierung (IgM
Þ IgG) des
Krankheitskeims (z.B. antigene
wandlungsfähige Borrelien), können
entsprechende Antikörper, nach der allgemeinen Lehre der
Immunologie, zumindest für lange Zeit vollständig
ausbleiben. Dies könnte eventuell zu einer sogenannten
„Non-Responder Borreliose“
[7] führen, die dann
möglicher Weise als MS-Syndrom behandelt wird und nicht
zusätzlich ursächlich auf eine mögliche
Borrelien-Infektion. Werden dann vorallem nur
Entzündungs-hemmer verabreicht, ist es vorstellbar das eine
spezifische Borrelien-Antikörperreaktion vollkommen
ausbleibt.
|
|
|
|
|
|
War
das Immunsystem vormals schonmal mit einem bestimmten Antigen
(Peptide, Epitop, Kontaktstelle von
Krankheitskeim etc.) in Kontakt gekommen, so wird das
Immunsystem bei erneutem Kontakt dies i.d.R. sofort wieder
erkennen und genau hierauf seine Hauptantwort richten. Diese muss
dann nach der Lehrmeinung der Immunologie nicht spezifisch gegen
den eigentlichen Krankheitskeim ausfallen, da eine Rückmeldung
erfolgt das die gebildeten Antikörper
(Kreuzreaktions-Re-Infektions-Antikörper)
eine Bindung eingehen. Dies macht sich z.B. die Medizin bei
Immunisierungen (Impfen) zu Nutzen,
hier verwendet man verwandte Krankheitserreger oder heute auch
künstlich hergestellte entsprechende Antigen-Peptide zur
Immunisierung gegen einem bestimmten Krankheitskeim. Die Reaktion
kann sich natürlich auch hauptsächlich gegen ein Antigen
ausrichtet, welches auch in ähnlicher oder gleicher Form bei
anderen Krankheitserregern vorkommt, man spricht dann von
kreuzreaktiven Antigenen oder Krankheitskeimen (z.B.
HSPs: Wirt Û Keim / Keim-A
Û Keim-B).
|
|
|
|
|
|
So
ist es vorstellbar wenn jemand zum Zeitpunkt der
Borrelienübertragung schon latenter Träger des
EBV-Erregers ist, die Antikörperreaktion sich in erster Linie
gegen die kreuzreaktiven Antigene (EBV zu
Bb.sl-Komplex) ausrichtet. Die gebildeten Antikörper
würden eine Bindung mit dem entsprechenden
ähnlichen/kreuzreaktiven Antigen-Peptiden der Borrelien
eingehen, somit eine positive Rückmeldung zu den
antikörperbildenden Zellen senden das dies genau die
richtigen und passenden Antikörper für den Eindringling
sind. Die Borrelien würden dann nach und nach ihre
Oberflächenstruktur (z.B. Bb.-Osp-A zu
Bb.-Osp-C etc.) wandeln um sich ihn ihre Verstecke
(Zell-Nischen, Bindegewebe usw.)
zurückziehen zu können, so das die frei im Blut
schwimmenden Kreuzreaktions-Antikörper immer seltener eine
Bindung eingehen würden, was dann wiederum das Immunsystem
dazu veranlassen würde die Antikörperreaktion auf ein
Minimum herunterzuregeln bzw. einzustellen. Antikörper die
als spezifisch für Borrelien gelten, müssten bei
diesem Infektionsmodell nicht in Erscheinung treten. Wenn doch
spezifische Antikörper gebildet würden, durch sehr
kurzzeitigem Kontakt zum Borrelien-Antigen-Peptid, müssten
sie nicht unbedingt den in der Serodiagnostik als
Borrelien-positiv geltenden Schwellenwert überschreiten
- Schwellenwerte siehe unter [B]. Ein
Kreuzreaktionsverhältnis kann natürlich auch zu
sogenannten Selbst-Antigenen (Körpereigenkodierung)
bestehen, auch wenn diese gar nicht von ihrer kristallinen
Struktur zu 100 Prozent ähnlich sind. Wegen der
genetischen oder Struktur-dominanten Prädisposition
erfolgt dann eventuell keine serologisch nachweisbare
(unterhalb Schwellenwert [B])
Aktivierung spezifischer Borrelien-Antikörper,
sondern statt dessen werden nur sogenannte Bystander
aktiviert. Unter Bystander versteht man in der
Immunologie, Immunzellen mit AG-Peptiden (Antigen-Kontaktstellen
der Rezeptoren) die eine dem Original ähnliche
kristalline Kontakt-Struktur (ca. 50 %
Ähnlichkeit genügen) besitzen [9].
Die Bystander-Aktivierung wäre dann einer der initialen
“Motoren“ für weitere autoimmune Reaktionen, die
unter ungünstigen Umständen dann zu weitern sich
verstärkenden autoreaktiven Reaktionen führen können.
|
|
|
|
|
|
Wenn
die Antikörper und Antigen sich in einem ausgewogenen
Verhältnis befinden, oder die Antikörper sogenannte
Komplexverbindungen eingehen, würden serologische Tests auch
eine negatives Ergebnis erbringen. Das
Antigen-Antikörper-Verhältnis kann z.B. durch eine
kurzzeitige Antibiose gestört werden, wodurch ein erneuter
Test bei vorliegender Borrelien-Infektion dann häufig
positiv ausfällt [11] und
Komplexverbindungen können theoretisch aufgebrochen werde.
Labortechnisch ist es circa seit 1990
möglich diese Komplexverbindungen aufzubrechen (steht
allerdings unter Patentschutz), dies Verfahren wird aber
i.d.R. bei den gängigen Borrelia-Tests nicht
angewandt. In Vergleichsstudien an Hautproben wurde
aufgedeckt, dass durch diese Nicht-Nutzung der Methode ca. 50 %
der Borrelia-Infektionen als negativ durchrutschen [12].
|
|
|
|
|
|
Die
Behauptung einiger Mediziner das es keine Infektionen ohne
Antikörperreaktion gibt, ist sicherlich im Prinzip
richtig. Auch eine vom Krankheitskeim angestoßene
Antikörperreaktion die sich vorrangig gegen krauzreaktive
Antigene (z.B. HSPs) oder
Selbst-Antigene (z.B. MBP)
richtet, ist im Prinzip eine Antikörperreaktion auf
dem Keim. Somit haben die Mediziner Recht. Die
Antikörperreaktion muss sich aber nicht immer in dem
für einen Krankheitskeim als spezifisch geltenden Bereich
abspielen, vorallem dann nicht wenn die Krankheitskeime, so
wie die Borrelien, in der Lage sind, z.B. durch
Gen-Regulation, den komplexen immunologischen Erkennungsprozess
negativ zu beeinflussen (siehe Seite
Merkblatt, Absatz: Tarnstrategien der Borrelien).
|
|
|
|
|
|
Es
gilt inzwischen als gesichert das durch die sogenannten
Galaktolipide der Borrelien (Bb.sl.-Komplex)
eine autoreaktive Antikörperbildung ausgelöst werden
kann, welche man mit folgender Kurzbezeichnung benennt: GM1,
GD1b und GT1b. Diese Antikörper sind allesamt
Autoimmun-Antikörper, die sich vor allem kreuzreaktiv
gegen die Plasmamembran der Nervenzellen (Gangliosid)
richten und dort insbesondere an deren Einschnürungen
bzw. Unterbrechungen der Markscheiden (Ranvierschen
Knoten) Entzündungen verursachen. Die
Borrelien-Galaktolipide können aber auch direkt zur
Aktivierung von Makrophagen führen, die dann
Entzündungen an den Gliazellen hervorrufen [10].
|
|
|
|
|
|
Dies
wäre keine als Borrelien-spezifisch erkennbare
Antikörperreaktion, und doch eine Immunantwort auf die
Borrelien. Somit haben die Mediziner recht, das immer eine
Antikörperreaktion auf Borrelien stattfindet, aber
leider wohl nicht immer in dem Bereich der langläufig als
Borrelien-spezifisch und typische gilt.
|
|
|
|
|
|
Auch
konnte bei Versuchen gezeigt werden das die Borrelien
Proteine (Rezeptoren)
besitzen die für eine Anheftung der Borrelien an den
Nervenzellen (Neurone, Glia- u.
Schwannschen Zellen), bzw. an deren Myelin-Komponenten
(Glykophingolipid), verantwortlich
sind. Es handelt sich hierbei z.B. um die
Borrelien-Proteine mit dem Molekulargewicht von 41 kD, 62 kD
und 67 kD (siehe Seite:
Gegenüberstellung der Molekular-gewichtsspuren von Genotyp 1
u. Genotyp 2). Nach dem Anheften der Borrelien
kann es dann zur erhöhten Ausschüttung von den Zytokinen
IL-6 und TNF-a kommen,
wodurch lokale Entzündungsherde entstehen, mit der Folge von
Verletzung der entsprechenden Nerven [10].
Tritt konzentriert TNF-a auf,
löst dies die Isolationsschicht der Nerven auf
[19] . Kann man nur eine der KD-Bande
(41, 62 o. 67 kD), zusammen mit den
oben beschriebenen autoreaktiven Antikörpern nachweisen,
würde der Test i.d.R. als Borrelia-negativ bewertet.
So wird z.B. die 67 kD-Bande (66-75 kD)
i.d.R. nur zusammen mit einer als hochspezifisch für
Borrelien geltenen kD-Bande (z.B. aus der 83
bis 100 kD-Gruppe), in den Routinetests, als
Borrelia-positiv gewertet. Vielleicht ein fataler Irrtum!
So hat man bei Versuchen mit Affen zeigen können, das die
Tiere mit Borrelia-Befall das ZNS alle nur eine
Borrelien-spezifische-kD-Bande aufwiesen. Die
Forscher stuften dies als bemerkemswert ein, da die Affen,
wären sie Menschen gewesen, alle als unbestätigte
Lyme-Borreliose (Borrelia negativ)
eingestuft worden wären. Die Forscher stellten bei ihren
Versuchen auch fest, dass der Befall des ZNS mit Borrelien,
bei einer Borrelien-Infektion, wesentlich gewöhnlicher
ist als bisher gedacht [43].
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Möglicher
Zusammenhang Borrelia burgdorferi (Bb.sl.-Komplex)
und MS-Syndrom kurz zusammengefasst:
|
|
|
|
|
|
Die
für dieses Kapitel verwendeten Literatur darf nur als
Beispiel betrachtet werden, stellvertretend für die
zahlreichen Veröffentlichungen mit entsprechenden Themen.
Hinweise dieser Art kann in erheblich mehr Literatur oder
Dissertationen gefunden werden. Ich möchte in diesen Kapitel
nur eine kleine Zusammenstellung liefern, die einen möglichen
Zusammenhang zwischen Borreliose und MS-Syndrom eventuell stützt.
Natürlich treten einige der aufgeführten Faktoren
auch bei anderen Krankheiten auf, ob sie auch so konzentriert
bei diesen Erkrankungen auftreten, kann ich nicht beantworten. Der
GD1b Antikörper tritt z.B. auch bei diversen Neuropathien,
dem Guillain-Barré Syndrom, Polyradikuloneuropathien und
natürlich deim Multiple Sklerose Syndrom auf (siehe
auch Seite: Gegenüberstellung der Molekulargewichtsspuren B.
Genotyp 1 / B. Genotyp 2). Bei genauerer Betrachtung
fällt einem auf, dass einige dieser “Erkrankungen“
eigentlich als Syndrom eingestuft werden müssen und auch in
Zusammenhang mit Lyme-Borreliose in der Fachliteratur beschrieben
werden.
|
|
|
|
|
|
·
Die Prävalenz- und Endemiegebiete von der
low-dose-borreliosis (Bb.sl.-Komplex)
und dem MS-Syndrom decken sich mit wenigen Ausnahmen fast
vollständig. Vorkommen beider Erkrankungsbilder findet
man vorrangig in den gemäßigten Klimazonen.
Lyme-Borrelien (Bb.sl.-Komplex)
kommen in den gemäßigten Klimazonen von Mittel-, Ost-
und Nordeuropa, Asien, Nordamerika sowie in Australien vor
[30/66/67]. In der
zahlreichen Literatur (z.B: [1],
[40] etc.) zum Thema MS
kann man nachlesen das dies Syndrom vorrangig in Mittel- u.
Nordeuropa, im Norden der USA (u. Südl.
Kanada) und Südosten von Australien sowie in
Neuseeland auftritt, also äquatorferne Regionen (gemäßigte
Klimazonen). In Europa sollen die Zonen hoher (>
40/100.000) und mittlerer (5-40/100.000)
MS-Prävalenz abhängig von der geographischen Breite sein
und Küstenlinien und Gebirgsläufen folgen [40],
also ähnlich dem gehäuften Vorkommen von Zecken und
ihren Krankheitskeimen (siehe Seite: Globale
Verbreitung der Borreliose und Multiple Sklerose).
|
|
|
|
|
|
·
Es kann mit den im Frühjahr gehäuft auftretenden
Zecken-(Stichen) ein gewisser saisonaler Zusammenhang vom
MS-Syndrom und Schizophrenie beobachtet werden, was auch ein
indirekter Indiz für eine ursächliche
Borrelien-Infektion als Auslöser sein kann [64/65].
|
|
|
|
|
|
·
Die klinische Erscheinungsbilder von Neuro-Borreliose und dem
schubförmigen MS-Syndrom sind sich sehr ähnlich, wenn
nicht sogar von der Symptomatik her identisch. Aus diesem
Grund kann man auch folgendes zum Thema nachlesen (Zitat aus [1]):
>>Daneben können diese Borrelien aber auch im
Zentralnervensystem zu einer Entzündung führen, die sich
ähnlich wie MS auswirken kann (Neuroborreliose). Durch genaue
Untersuchungen des Blutes und des Liquors kann man dies jedoch
meist klären. Im Zweifelsfall ist eine Behandlung der
Borreliose zu empfehlen.<<
|
|
|
|
|
|
·
Unter entsprechenden Umständen sind bei zerebralvaskulärer
Neuro-Borreliose Läsionen mittels T1-gewichteten
u./o. T2-gewichteten
MRT (o.
MRI [N])
durch eine
Gadolinium-Anreicherung
(Gd
[N])
Signalsteigerung
nachweisbar [53],
auch bei Borrelien-Meningitis kommt es zu mit MRT (MRI
Gd-DTPA) nachweisbaren diffusen Erscheinungen im ZNS
[70].
Bei der Diagnose des MS-Syndroms gelten Läsionen in der
T2-gewichteten
MRT auch als ein zuverlässiger Frühindikator [54].
Die Diagnose MS wird gestellt wenn nach dem ersten (!?)
Krankheitsschub mit klinisch nachweisbaren Auffälligkeiten in
mindestens einem Funktionssystem, mittels MRT, mehrere Herde
(Läsionen)
in definierter Lage
vorhanden sind, von denen mindestens einer Gadolinium (Gd)
anreichern sollte [23].
Circa 90 Prozent der MS-Patienten zeigen solche Herde (Läsionen),
die aber von Herden anderer Ursache oft nicht sicher
unterscheidbar sind. Deswegen sollte die Diagnose MS-Syndrom
nicht allein aufgrund eines Kernspintomogramms gestellt werden
[1].
Erst
jüngst wurden wieder
Überschneidung beim bildgebenden (MR
bzw. MRT) Verfahren in puncto Diagnoseverfahren
der Multiple Sklerose (MS) und Neuro-Borreliose (NB
/ CNB o. LNB) beschrieben. Was eine
Abgrenzung des MS-Syndroms anderer Ursache gegen Neuro-Borreliose
schwierig macht, galt doch häufig eine Sichtbarmachung
der angeblich nur für das MS-Syndrom typischen entzündlichen
Herde als beweisend für das Syndrom. Die Autoren schlagen
anhand der von ihnen im bildgebenden Verfahren gemachten Befunde
für die Neuro-Borreliose autoimmune Reaktionen vor,
so wie sie beim MS-Syndrom beobachtet werden können (Stand
2009 [99]).
|
|
|
|
|
|
·
Bei circa 75 Prozent der Patienten die eine aktive
Neuro-Borreliose (ZNS-Lyme)
durchleben ist ein abnormales messbares Ergebnis im QEEG
(Quantitative Elektroencephalograph)
u./o. EPs (evoziertes Potential)
nachweisbar, welche sich nach einer Behandlung
normalisieren [71]. Auch bei der
MS-Syndrom-Diagnostik kommt den elektrischen
Potentialmessungen (EPs) im Gehirn eine Bedeutung zu,
als ergänzende Möglichkeit zur Absicherung der leichten
und frühen Störungen. Bei der MS-syndrom-Diagnostik soll
insbesondere das visuell evozierten Potential (VEP)
eine diagnostische Bedeutung haben, da hiermit die
Leitungsgeschwindigkeit vom Sehnerv gemessen wird [1]
(Zum Sehnerv siehe auch Seite “Symptome
und Stadien, Stadium 4, Glaukom bzw. Grüner Star“
[91]).
|
|
|
|
|
|
·
Bei der Neuro-Borreliose (sogen.
Zerebrovaskuläre NB) kann es zur
erregervermittelten Vaskulitis kommen, die im ZNS zu
Läsionen führen kann [53].
Zum MS-Syndrom heißt es in entsprechender
Fachliteratur: die frühsten krankhaften Erscheinungen sind
nicht an den Nerven- und Gliazellen zu finden, sondern in und
an den Blutgefäßen [41].
|
|
|
|
|
|
·
Borrelia Osp-A Peptide, bzw. die Antikörper hierauf,
sind reaktiv mit Neuronen des ZNS (Gehirn
und Rückenmark) und den Dorsalwurzelganglien
[56]. Weiter konnte inzwischen ein
monoklonaler Antikörper (sogen.
H9724) charakterisiert werden, der eigentlich auf
das 41 kD flagellar-Protein der Borrelien ausgerichtet ist.
Aber der Antikörper H9724 reagiert auch mit
menschlichen Axonen (Leitbahn der
Nervenzellausstülpungen - siehe oben) und erkennt ein
MHC-Protein (siehe Seite: Merkblatt, Punkt
40, HLA/MHC-Proteine) der menschlichen neuroblastoma Zellen
[63]. Gerade irreversible
neuronalen-axonalen Schäden werden von einigen
Fachleuten beim MS-Syndrom als entscheidender Faktor
eingestuft, die im MRT [N] als
permanente “schwarze Löcher“ (black
holes) erscheinen sollen [24].
|
|
|
|
|
|
·
Alleine Borrelia Osp-C führt durch seine
Anwesenheit zu clusterartigen axonalen Schäden im
Gehirn, dies konnte in Laborversuchen an Mäusen gezeigt
werden. Das Borrelien Osp-C startet durch seine Anwesenheit eine
Aktivierung von Mikrogliazellen, welche in Folge durch eine
verstärkte Freisetzung von NO, TNF-a,
IL-6 etc. zu entzündlichen Veränderungen im Gehirn
(insbesondere Axone) mit
entsprechenden Schäden führt. Bei Menschen
(Norwegen) mit Neuroborreliose konnte
ähnliches beobachtet werden, sie zeigten ca. 30 Monate nach
Beginn einer Neuroborreliose eben solche Schäden im Gehirn
[117].
|
|
|
|
|
|
·
Oligoklonale Bande: Hierbei handelt es sich um den Nachweis
einer vermehrte Eiweißfraktion im Liquor (Hirnwasser),
welche die Antikörper (AK)
enthält. Es sollten im speziellen beim MS-Syndrom die IgG-AK
erhöht sein, die von wenigen (oligo)
Lymphozyten-Zellstämmen (Klonen)
gebildet wurden. Oligoklonale Antikörper sollen beim
MS-Syndrom zu jedem Zeitpunkt nachweisbar sein, auch nach
einem Schub, ohne dass Beschwerden vorhanden sein müssen [1].
Auch bei der Borreliose (Stadium 3)
kann im Liquor eine Pleozytose (erhöhte
Zahl an Zellen), Gesamteiweißerhöhung (Eiweiße
des Blutplasmas) und regelmäßig eine
spezifische Antikörperbildung mit den dafür typischen
oligoklonalen Banden festgestellt werden [72].
|
|
|
|
|
|
·
Beim Multiple Sklerose Syndrom und Neuro-Borreliose kommt es
zur sogenannten polyklonalen Immunstimulation, die aber auch
bei anderen Infektionen beobachtet werden kann - z.B. bei
Infektionen mit Herpes-Simplex Viren, Varizella-Zoster,
Masern und Röteln [55] (siehe
auch oben MRZ-Reaktion), es sind quasi alles
MS-Syndrom-Verdachtsviren
|
|
|
|
|
|
·
Entzündungsherde treten sowohl beim Multiple Sklerose
Syndrom und der Neuro-Borreliose im ZNS auf, Bei der Borreliose
(Neuro-Borreliose / NB) ist das
Gehirn mit betroffen, da u.a. Mikroglia-Zellen
(Immunzellen im ZNS) die durch B.
burgdorferi aktiviert wurden Entzündungsreaktionen
herbeiführen, die dann auf die umgebenden Nervenzellen
sekundär toxisch wirken und diese als Folge zum
Absterben bringen [104]
.
|
|
|
|
|
|
·
Autoreaktive Antikörper: bei folgenden Erkrankungen
und Infektionen sind anti-myelin-basic-proteine (anti-MBP)
und anti-ganglioside 1 (anti-GM1)
Reaktionen zu beobachten: Borreliose, andere bakterielle
Erkrankungen, Herpes-Simplex-Virus Encephalitis (HSVE),
Multiple Sklerose Syndrom (MS), subakute Sklerosis-panencephalitis
(SSPE) und Glioblastoma. Am ähnlichsten sind sich die
Antikörperunterklassen beim MS-Syndrom und Borreliose. Beim
MS-Syndrom konnten vorrangig die Unterklassen IgG1, IgG3 u. IgG4
und bei Borreliose IgG1, IgG2 u. IgG3 nachgewiesen werden [57]
- hingegen beschränkt sich bei den MRZ-Viren die
Immunantwort auf die Unterklasse IgG1 [57].
Das MBP hat z.B. mit dem Osp-C von Borrelia burgdorferi ss.
(Bb. B31) eine Nukleotid-Reihenfolgen-Identität von 84-85
Prozent und eine Aminosäuren-Identität von 76-79 Prozent
[58]. In experimentellen
Immunisierungsversuchen konnte gezeigt werden, das Borrelia
burgdorferi eine Antikörperreaktion auf Ganglioside
verursacht [59]. Vorgenanntes gilt
inzwischen als gesichert, Borrelien-Galaktolipide lösen
autoreaktive GM1, GD1b und GT1b aus die sich vorallem gegen die
Plasmamembran der Markscheiden (Ganglioside)
richten [60]. So konnte bei
Neuro-Borreliosepatienten auch ein erhöhter anti-a
B-crystallin AK-Titer (IgG) im
Serum und Hirnwasser (Liquor)
nachgewiesen werden, ähnlich hohe anti-a
B-crystallin AK-Titer (IgM)
werden auch beim MS-Syndrom beobachtet [77].
|
|
|
|
|
|
·
Autoreaktive Immunzellen: Es konnte gezeigt werden das
Borrelien-Galaktolipide Makrophagen aktivieren, die direkt
Entzündungen an den Gliazellen hervorrufen [60].
Bei T-Zellen konnte ähnliches beobachtet werden. Es
wurden T-Zellen identifiziert die sowohl Borrelia burgdorferi
erkannten als auch reaktiv zum MBP waren, Allerdings sollen die
T-Zell-Klonen dieser Linien nur das Original-Antigen erkannt haben
[61]. Bei weiteren Studien mit
Borreliosepatienten die unter starken neurologischen Problemen
litten, hat man zeigen können das im späten Stadium
(3. Stadium) der Erkrankung nicht
nur Borrelia bestimmte T-Zellen auftreten können,
sondern auch reaktive zum ZNS und PNS [69].
Es konnten immer mehr relevante kreuzreaktive Peptide
(relevante Kontaktstellen) z.B.
zwischen dem Borrelien Osp-A und dem menschlichen HLA-DR4
nachgewiesen werden. Hierbei konnte bewiesen werden, dass
Osp-A-spezifische T-Zellen Selbstantigen-Peptide erkennen, obwohl
diese nicht eine einzige Aminosäure des eigentlichen
Borrelien-Osp-A aufweisen [62]
(HLA-System siehe Seite: Merkblatt,
Punkt 44). Bei Untersuchungen an 505 T-Zell-Linien die
auf Borrelia burgdorferi geprüft wurden, konnte gezeigt
werden das 16 MBP, 16 peripheral Myelin, 2 Galactocerebrosid und
eine T-Zell-Linie Cardiolipin autoreaktiv waren [69].
Auch hat man beweisen können das T-Zellen wesentlich
flexibler auf Antigenstrukturen reagieren als bisher geglaubt, das
heißt, es kommt bei Ähnlichkeiten häufiger zu
Kreuzreaktivität (Selbstantigen /
Fremdantigen) als bisher angenommen. Weiter wurde in diesen
Immunzellstudien gezeigt, dass es zu einer sogenannten
“Bystander“-aktivierung unter den T-Zellen (T-Killer-
u. T-Helferzellen) kommt. Bei den “Bystander-Immunzellen“
handelt es sich um Immunzellen die eigentlich nicht spezifisch auf
die Antigenstruktur des Krankheitskeims ausgerichtet sind, aber
letztendlich zu Reaktionen gegen Selbst führen (Immunopathien
/ Autoimmunreaktion) [9]. 8
von 13 Patienten mit Neuro-Borreliose zeigt “anti-MBP
IgG-AK-Zellen“ im Hirnwasser, unabhängig von der Phase
der Erkrankung - nach erfolgreicher Behandlung nahm die Zahl
der entsprechenden “anti-MBP IgG-AK-Zellen“ ab. Die
“anti-MBP IgG-AK-Zellen“ kamen nur im Hirnwaser vor,
nicht im Blut des Patienten. Allerdings konnte man diese Zellen
auch bei anderen inflamtorischen (entzündlichen)
Erkrankungen des ZNS beobachten [68].
Auch bei beim MS-Syndrom spielen die T-Zellen eine wichtige
Rolle bei der autoreaktiven Ausrichtung des Immunsystems, es
heißt das sie beim MS-Syndrom im Zentrum der Immunantwort
stehn [23].
|
|
|
|
|
|
·
Es konnten Rezeptoren bzw. Proteine der Borrelien
aufgedeckt werden die eine molekulare Bindung (=
Affinität) zu Nervenzellen (Neurone,
Glia- u. Schwannschen Zellen) oder besser gesagt zu deren
Myelin-Komponente (Glyophingolipid)
besitzen, sie verbergen sich hinter dem Molekulargewicht
der 41-, 62- (Hsp 60) und 67
kD-Bande. Nach dem Anheften der Borrelien mittels
dieser Anker-Rezeptoren kann es dann zur erhöhten
Ausschüttung von den Zytokinen IL-6 und TNF-a
kommen, wodurch lokale Entzündungsherde entstehen,
mit der Folge von eventuellen Verletzung an den Nervenbahnen [60].
TNF-a (u.TNF-b)
haben eine zytotoxische Wirkung auf Oligodendrozyten,
welche für die Bildung neuer Markscheiden im ZNS
verantwortlich sind. Weiter hat TNF-a
eine erweichende Wirkung auf die Blut-Hirn-Schranke [23].
Die Borrelien stülpen im Menschen folgende HSPs
(Hitze-Schock-Protein) aus:
60-, 62-, 72- u. 74 kD. Die Borrelien-Proteine p66 (66
kD), p28 (28 kD) u./o. P45 (45
kD) verursachen vermutlich HSP-Antikörper, allerdings
sind HSPs nicht immer über Antikörper feststellbar.
Treten anti-p66, anti-p28 u./o. anti-p45 Antikörper bei
einer Borreliose mit neurologischen Problemen auf, ist ein
MS-Syndrom zu erwarten [42].
|
|
|
|
|
|
·
Die Borrelien besitzen einen Ligand (=
Membranrezeptor bindungsfähige Substanz) zum
Integrin aMb2,
welches ein Zellbindungsrezeptor für die Matrix
in den Zellzwischenräumen (ICAM /
intercellular adhesions molecule) darstellt und an den
Zusammenhalt der Blut-Gefäßzellen (Blutadern)
beteiligt ist (VCAM / vascular cell
adhesion molecule) [73]. Es
konnte eindeutig bewiesen werden, dass die
Regulation folgender Gene, MIP-2a
und ICAM-1, Borrelien-spezifisch ist
[74], auch hier findet sich eine
Borrelien-bedingte Einflussnahme auf die ICA-Moleküle
(ICAM). Diese Adhäsionsmoleküle
(ICAM-1/-3, VCAM etc.) der
Immunzellen und Endothelien gelten auch als Aktivitätsmarker
des MS-Syndroms. So deuten z.B. Untersuchungen bezüglich
der ICAM-1 Expression auf T-Zellen darauf hin, dass diese als
Beurteilung der Krankheitsaktivität beim schubförmigen
MS-Syndrom (schubförmig remittierender
MS) von Bedeutung sein können [75].
|
|
|
|
|
|
·
Auf der Ebene der Matrix-Metalloproteinasen (MMPs)
hat vorallem die Galatinase MMP-9, als sogenannter
Aktivitätsmarker, eine Bedeutung bei der
MS-Syndrom-Diagnostik [75].
Auch in Zusammenhang mit Borrelien konnte im
in-vitro-Modell (Labor) eine
Veränderung auf der Ebene von MMP-9 nachgewiesen werden
[76].
|
|
|
|
|
|
·
Wird bei einer Borrelien-Infektion die Gruppe der
CD4-T-Zellen (CD4+ Zellen) angeregt,
insbesondere die CD4-Zell-Unter-Gruppen der TH1-Zellen, nimmt die
Borreliose einen chronischen Verlauf. TH1-Zellen aktivieren
neben dem TNF-a
(Tumornekrosefaktor), INF-b
u. INF-g (Interferone)
und das IL-2 (Interleukin).
Hierdurch stimulieren sie ihre eigene Vermehrung und hemmen eine
TH2-Zell-Bildung sowie die Synthese von IgG1-Antikörper
(IgG1-AK), denen bei Borreliose
nachweislich eine schützende Wirkung zukommt. Tatsächlich
sorgen die TH1-Zellen, über die vermehrte Ausschüttung
von Gamma-Interferon (INFg)
für die Produktion von IgG3-Antikörpern, die
nachweislich am pathogenen (krankhaften)
chronischen Verlauf einer Borreliose beteiligt sind [76].
Auch einigen dieser Faktoren kommt als sogenannte
Surrogatmarker der Prozessaktivität in der
MS-Syndrom-Diagnostik eine Bedeutung zu, da sie mit Immunreaktion
gegen die Nervenscheiden in Verbindung gebracht werden. Hierbei
handelt es sich um den Tumornekrosefaktor (TNF-a),
Interferon gamma (INF-g)
und Interleukin 2 (IL-2) [75].
Bei akuten MS-Schüben sind die Zytokine IL-1, IL-2,
INF-g und TNF-a
erhöht und IL-4, IL-10, TGF-b
(transforming growth factor)
vermindert. In den Zwischenphasen der Erholung sind hingegen die
Zytokine IL-10 und TGF-b erhöht
[23].
|
|
|
|
|
|
·
Der Direktnachweis von widerstandsfähigen
intrzellulären veränderten Borrelien (zystische
Borrelien), sogenannte Blebs und pleomorphe Formen in
Neuronen- und Glia-Zellen [95].
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Begünstigen
Chlamydia pneumoniae und Borrelia burgdorferi s.l.
zusammen MS-Pathomechanismen?
|
|
|
|
|
|
·
Bei einer Borrelien-Infektion kommt es zu einer
verstärkten IFN-g-Produktion
und verminderten IL-4-Synthese, dies beruht mit großer
Wahrscheinlichkeit auf die Inaktivierung von TH2-Zellen. Diese
Inaktivierung der TH2-Zellen wird für eine Verschlechterung
der Borreliose verantwortlich gemacht, da sie einhergeht mit einer
allgemein verminderten Immunantwort [76].
IFN-g hat auf eine
Chlamydia pneumoniae Infektion wiederum eher eine
drosselnde Wirkung, da dies die Chlamydia-Retikularteilchen
in den Wirtszellen ruhen lässt [44/52].
Die persistierenden Chlamydien lassen sich unter diesen
Bedingungen auch nicht mehr anzüchten (Ein
Direktnachweis im Labor gelingt nicht), setzen aber immer
noch bakterientypische Stoffe wie Chlamydien-HSPs
(cHSP-60) und
Chlamydien-Lipopolysaccharid (cLPS)
frei [44]. Es ist daher denkbar,
das auf einen abklingenden Borrelia-Krankheitsschub, der
mit einer verminderten IFN-g-Produktion
einhergeht, als Folge ein Chlamydien-bedingter
Krankheitschub folgt. Die Immunabwehr könnte durch den
abrupten Wechsel vom Ruhezustand des einen Erregers, zur
Aktivitätsphase des anderen Erregers irritiert werden und
somit vielleicht eher eine Eliminierung autoreaktiver Immunzellen
unterbleiben. Geschieht doch die Umwandlung von
intrazellulären Chlamydien zu extrazellulären
Chlamydien innerhalb von 48-72 Stunden [48].
Eine Neuidentifizierung des Keims (Antigen)
bedarf hingegen circa 5 Tage, da die antigenstimulierten B-Zellen
erst zurück ins Knochenmark wandern müssen, um dort zu
antikörperproduzierenden Plasmazellen heranzureifen.
|
|
|
|
|
|
·
Chlamydia pneumoniae führt zu schubförmigen
Entzündungen (episodische Vaskulitis)
die zu winzigen Löchern in den Wänden der
Mikro-Blutgefäße führen, hierdurch
können in Folge Blut-Bestandteile in den umliegenden
Raum gelangen [41]. Kommen
degenerierte Borrelien (zystischen
Borrelien, L-Form Borrelien etc.) in ihren
Rückzugsort, z.B. im ZNS, wieder mit Stoffen aus
dem Blut (bzw. Serum) in
Kontakt, verwandeln sich diese zurück in ihre ursprüngliche
bewegliche Form [69]. Dieser
Vorgang würde sie wieder für die Immunabwehr
sichtbar machen, somit dann zu weiteren Abwehrreaktionen in den
betroffenen Bereichen führen. Das ZNS (Gehirn
u. Rückenmark) gilt normalerweise als sogenannter
immunprivilegierter Ort, was soviel bedeutet das es von der
Immunabwehr im Normalzustand eher weniger erreicht wird. Dies
macht das ZNS als Rückzugsort für die Borrelien (auch
für andere Erreger) so attraktiv. Durch den eben
Beschriebenen Vorgang könnte es zu einer ausgeprägten
Blut-Hirn-Schrankenstörung kommen, mit all ihren Folgen.
Verstärktes Einströmen von Stoffen in das ZNS, z.B.
von Albumin, das ein Eiweiß ist welches
ausschließlich in der Leber synthetisiert wird - deswegen
gilt es als klassischer Indikator einer
Blut-Hirn-Schrankenstörung. Neben dem Albumin gelangen dann
aber auch leichter Antikörper, Entzündungsmediatoren,
Immunzellen sowie auch weitere Krankheitserreger ins Gehirn
denen es sonst nicht oder nur schwer gelingt. Vorstellbarer
Vorgang: Atemwegsinfekt mit Chlamydia pneumoniae Þ
Schädigung der Kapillargefäße Þ
Reaktivierung zystischer Borrelien (L-Form
Borrelien) durch Blut-Bestandteile Þ
Bildung autoreaktiver Immunzellen und Antikörper Þ
neuer oder erster MS-Syndrom-Schub.
|
|
|
|
|
|
·
Sowohl Chlamydia pneumoniae und auch Borrelien
befallen Epithelzellen, beide Erreger zusammen führen dann
eventuell zu einen sich verstärkenden Entzündungseffekt
in den betroffenen Bereichen (z.B. in
den Mikro-Blutgefäßen). Die Borrelien
regeln bei den von ihnen befallen Zellen die Andockstellen
für Immunzellen mittels Beeinflussung des ICAM-1-Gens
herunter [74], und Chlamydia
pneumoniae führt wahrscheinlich zur Unterdrückung
der Körpereigenkodierung (MHC-Faktor
1) auf den von ihnen befallenen Zellen [44].
Immunzellen (T-Zellen) die
sich eigentlich gegen die intrazellulären Borrelien
richten, können nicht wegen der ICAM-1-Genregulation an
diesen Zellen andocken, wodurch sie dann wahrscheinlich
benachbarte Zellen angreifen bei denen die Körpereigenkodierung
(MHC-Faktor 1) durch die
Chlamydien runter reguliert ist. Die Unterdrückung
des MHC-Faktor 1 kann dann dazu führen, dass die
körpereigenen Zellen eventuell als feindlich eingestuft
werden und somit zum eigentlichen Angriffsziel der Immunabwehr
werden. Die Folge könnten starke regionale
Entzündungsherde in den Gefäßen sein. Beim
MS-Syndrom soll es sich um ein klassisches Bild einer chronischen
Entzündung handeln, die von der Umgebung der Venolen
(Blut-Gefäße) aus im
weiteren Entzündungsverlauf auf die Markscheiden übergreift
[40] .
|
|
|
|
|
|
·
Durch kreuzreaktive Peptide (relevante
Kontaktstellen) der Borrelien kann es zur
Fehlausrichtung gegen Selbst-Antigene kommen, als Beispiel möchte
ich hier nur das basische Myelinprotein (MBP)
aufführen. Es konnte gezeigt werden das
Borrelien-Osp-A-spezifische T-Zellen Selbst-Antigene
erkennen [9]. Normalerweise
werden die fehlgeleiteten T-Zellen durch umfangreiche
immunologische Kontrollmechanismen erkannt und mittels dem
sogenannten Apoptose-System (Zellselbstmord-Reglkreis)
in den Tod getrieben. Da Chlamydia pneumoniae
auf verschiedenen Ebenen in den Apoptose-Regelkreis eingreift,
könnte dies eventuell zum Fortbestehen der autoreaktiv
ausgerichteten T-Zellen führen. Allerdings wirkt
Chlamydia pneumoniae in erster Linie Apoptose-inhibierende
(hemmende) auf Monozyten
(Makrophagen) und Epithelzellen [52],
für T-Zellen ist dies (noch)
nicht nachgewiesen.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Folgende
diagnostische Punkte sollten zum Ausschluss einer Neuro-Borreliose
durchgeführt werden:
|
|
|
|
|
|
Zitat
aus [77]:
Untersuchungsempfehlung der "Deutschen Gesellschaft für
Neurologie" bei angenommener Neuro-Borreliose (NB). Nach
meiner Erfahrung werden häufig nicht alle Punkte der
DGN-NB-Kriterien abgehakt, sondern vorschnell die Diagnose
Multiple Sklerose Syndrom gestellt (Unsicherheit
der Ärzte ?). Ich halte die DGN-Kriterien nach meinen
ganzen (Literatur)-Studium noch nichteinmal für ausreichend
um eine NB auszuschließen bzw. zu sichern, sondern um einige
diagnostischen Punkte ergänzungswürdig. Die von mir in
den DGN-Kriterien ergänzten Punkte sind kursiv
und farbig hervorgehoben eingefügt
- weitere in der Borrelia-Fachliteratur beschriebenen
Diagnosehilfen siehe Seite: Merkblatt.
|
|
|
|
|
|
|
|
|
|
|
|
NOTWENDIG:
|
|
|
|
|
|
·
Gezielte Anamnese mit Frage nach
Zeckenstichen, Aufenthalt in Endemiegebieten, Frühsymptomen
(Erythema migrans, Borrelien-Lymphozytom,
syn. Lymphadenosis cutis benigna, Allgemeinsymptome)
|
|
|
|
|
|
·
Neurologischer Status, Inspektion der Haut (Erythema
migrans kann zum Zeitpunkt der neurologischen Symptomatik noch
nachweisbar sein)
|
|
|
|
|
|
·
Liquoruntersuchung
|
|
|
|
|
|
-
Pleozytose (zahlreiche aktivierte
Lymphozyten, Plasmazellen)
|
|
|
|
|
|
-
Schrankenstörung
|
|
|
|
|
|
-
Intrathekale Immunglobulinsynthese (bei
akuter Neuroborreliose IgM > IgG und IgA, bei chronischer
Neuroborreliose IgG und IgA > IgM)
|
|
|
|
|
|
-
Spezifischer Antikörper-Index (AI;
Antikörperbestimmung zur Berechnung der borrelienspezifischen
intrathekalen IgG- bzw. IgM-Antikörpersynthese; diese liegt
vor bei einem AI ³ 2,0, bei > 90% der Fälle erhöht,
bei längerer
Krankheitsdauer in 99% der Fälle erhöht)
|
|
|
|
|
|
·
Borrelienserologie
|
|
|
|
|
|
-
einen "acylierten Cholesteryl-Galactosiden
(ACGal)-Test" durchführen, da
AC-Galactoside in Seren von Lyme-Borreliosepatienten i.d.R.
deutliche Reaktionen bewirken, bei anderen Patienten nach
derzeitigem Wissen nicht [78].
|
|
|
|
|
|
-
IgM-Antikörper: auch bei akuten Verläufen (Erythema
migrans) nur in ca. 40% der Fälle nachweisbar,
Titerabfall und Verschwinden der IgM-Antikörper oft erst nach
4-6 Monaten, gelegentlich jedoch Persistieren positiver IgM-Titer
(10%) über Jahre trotz
Beschwerdefreiheit
|
|
|
|
|
|
-
IgG-Antikörper: bei chronischen Verläufen häufig
höhere Titer als bei akuten Verläufen; zur Beurteilung
laborinterne Referenzwerte beachten; persistierende IgG-Titer (bis
25%) über viele Jahre trotz ausgeheilter Symptomatik
|
|
|
|
|
|
-
Falsch positive Befunde: bei akuter EBV-, VZV-, CMV-,
Lues-Hepatitis
|
|
|
|
|
|
-
Basislabor mit Entzündungsparametern
|
|
|
|
|
|
-
Nachweis der Bb.-typischen
HSP-kD-Bande. Die Borrelien-Proteine p66 (66 kD), p28 (28 kD)
u./o. P45 (45 kD) verursachen vermutlich HSP-Antikörper,
allerdings sind HSPs nicht immer über Antikörper
feststellbar. Treten anti-p66, anti-p28 u./o. anti-p45
Antikörper bei einer Borreliose mit neurologischen Problemen
auf, ist ein MS-Syndrom zu erwarten [42].
- dann sollte meiner Meinung nach schnellstens eine entsprechende
Antibiose eingeleitet werden.
|
|
|
|
|
|
-
Absolutzahlbestimmung der NK-Zellen (natural killer
cells bzw. NK-Zellen). Als spezifisches Zeichen für eine
Borrelieninfektion (Neuro-Borreliose / C-NB) gilt
insbesondere wenn die Absolutzahl bzw. der Anteil von
aktivierten NK-Zellen (CD3-CD56+CD57+) verringert ist.
Bei chronischen Borreliosefällen (Befall des
Nervensystems) soll die Anzahl von "CD57+ Zellen"
häufig unter 60 pro ein µl Blut liegen
[79/80/81].
Es sollte aber, insbesondere im Alter von 4-9 Jahren, eine
Abgrenzung gegen eine mögliche Mukoviszidose (zystische
Fibrose, cystic fibrosis / CF) erfolgen [82].
|
|
|
|
|
|
|
|
|
|
|
|
IM EINZELFALL
EMPFEHLENSWERT:
|
|
|
|
|
|
·
Nachweis von Borrelien-DNA
durch PCR (polymerase-chain-reaction)
in früher Krankheitsphase bei negativer Serologie, aber
klinisch eindeutigem Verdacht.
|
|
|
|
|
|
-
PCR-Test am Hirnwasser (CSF / Liquor Cerebrospinalis);
von der CSF-Abnahme bis zur DNA-Präparation sollten nicht
mehr als 6 h vergehen, PCR-rib und PCR-ospA sollen bessere
Ergebnisse liefern als z.B. PCR-fla [75].
|
|
|
|
|
|
·
Magnetresonanztomographie
des Schädels und der Wirbelsäule bei
Enzephalitis/Myelitis
|
|
|
|
|
|
·
Fazialisneurographie
|
|
|
|
|
|
·
Transkranielle Magnetstimulation
|
|
|
|
|
|
·
Neurographie peripherer Nerven
|
|
|
|
|
|
·
Elektromyographie
|
|
|
|
|
|
·
Evozierte Potenziale (somatosensibel,
akustisch, visuell evozierte Potenziale)
|
|
|
|
|
|
·
Elektroenzephalogramm
|
|
|
|
|
|
·
Hirnstammreflexe
|
|
|
|
|
|
·
MR-Angiographie, eventuell DSA (nur
bei Verdacht auf borrelieninduzierte Vaskulitis)
|
|
|
|
|
|
·
Nachweis der autoreaktiven Antikörper GM1, GD1b
u./o. GT1b zusammen mit dem Nachweis von einer oder
mehrere der entsprechenden kD-Bande/n (< 12, 20, 41, 62
u./o. 67 kD) - soll nur mittels hochempfindlichen
Geelelektrophorese gelingen die eine entsprechend lange Laufbahn
aufweist.
|
|
|
|
|
|
|
|
|
|
|
|
DIAGNOSTISCHE
KRITERIEN DER NEUROBORRELIOSE (Bewertung)
:
|
|
|
|
|
|
·
1.- Mögliche Neuroborreliose:
|
|
|
|
|
|
-
Typisches klinisches Bild (Hirnnervenausfälle,
Meningitis/Meningoradikulitis, fokale neurologische Ausfälle)
|
|
|
|
|
|
-
Borrelienspezifische IgG- und/oder IgM-Antikörper im Serum -
Kann meiner Meinung nach mit dem Kenntnisstand von 4/2007 nicht
so hingenommen werden, würde ich anders formulieren:
Bb.-spezifische AK sind kein Beweis für eine aktive
Borreliose, zusammen mit typischen Symptomen bestätigen sie
eine aktive Borreliose, nicht vorhandene spezifische Bb.-AK
schließen eine aktive Borreliose nicht aus.
|
|
|
|
|
|
-
Liquorbefund nicht vorliegend/Liquorpunktion nicht durchgeführt
|
|
|
|
|
|
·
2.- Wahrscheinliche Neuroborreliose - wie „mögliche
Neuroborreliose“, jedoch zusätzlich:
|
|
|
|
|
|
-
positiver Liquorbefund mit lymphozytärer Pleozytose,
Blut-/Liquorschrankenstörung mit oder ohne intrathekale
Immunglobulinsynthese
|
|
|
|
|
|
-
GM1, GD1b u./o. GT1b Antikörpertest ist positiv
|
|
|
|
|
|
-
mehrere HSP-kD-Bande (60-62, 66-75, 71-75 kD)
die durch Borrelien vermittelt sein können sind
positiv
|
|
|
|
|
|
-
Ausschluss anderer Ursachen für die vorliegende Symptomatik
|
|
|
|
|
|
·
3.- Gesicherte Neuroborreliose - wie
„wahrscheinliche Neuroborreliose“, jedoch zusätzlich:
|
|
|
|
|
|
-
intrathekale Synthese borrelienspezifischer Antikörper (IgG
und/oder IgM) im Liquor
|
|
|
|
|
|
-
oder positiver kultureller- oder Nukleinsäurenachweis (PCR)
im Liquor
|
|
|
|
|
|
-
und/oder positiver ACGal-Test
|
|
|
|
|
|
-
Absolutzahl der NK-Zellen (CD3-CD56+CD57+) ist vermindert
|
|
|
|
|
|
-
GM1, GD1b u./o. GT1b Antikörpertest ist positiv und die
hochempfindliche Geelelektrophorese mit langer Laufbahn weist eine
oder mehrere der entsprechenden kD-Bande (z.B. HSP-Bande) auf
|
|
|
|
|
|
-
Ausschluss anderer Ursachen für die vorliegende Symptomatik
|
|
|
|
|
|
|
|
|
|
|
|
CAVE (Vorsicht
bedenken):
|
|
|
|
|
|
·
bei atypischen Krankheitsbildern:
Koinzidenz (= gleichzeitiges Auftreten)
einer früher durchgemachten Neuroborreliose und einer aktuell
andern entzündlichen ZNS-Erkrankung bedenken.
|
|
|
|
|
|
Anmerkung
(A. Hartwig): was will man damit sagen? Doch wohl nicht etwa das
eine früher durchgemachte akute Neuro-Borreliose
(Primär-Erkrankung) zur chronischen entzündlichen
ZNS-Erkrankung, die man in diesem Zustand lieber Multiple Sklerose
(Sekundär-Erkrankung) nennt, geführt hat.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Autoimmunaggresionsmechanismen
beim MS-Syndrom / Multiple Sklerose:
|
|
|
|
|
|
Kurz
notiert:
|
|
|
|
|
|
Dies
Kapitel behandelt die Frage unter welchen Bedingungen es überhaupt
zur Einwanderung von autoreaktiven Immunzellen (z.B.
T-Zellen) und Antikörpern ins ZNS kommen kann,
eigentlich ist das ZNS nämlich ein sogenannter
immunprivilegierter Ort, das heißt, die Immunabwehr hat im
Normalfall (gesunden Zustand) nur
einen sehr eingeschränkten Zugang ins ZNS. Damit
autoreaktive Immunzellen überhaupt ins ZNS gelangen können,
müssen diese immer wieder im Blut bzw. außerhalb
des ZNS mit einem Selbst-Antigen in Kontakt kommen. Ansonsten
gelingt es ihnen nicht ins ZNS einzuwandern. Weiterer Umstand
der zum Einwandern von autoreaktiven Zellen und Antikörpern
ins ZNS führen kann, kann eine immer wiederkehrende
chronische Erweichung der Blut-Hirn-Schranke sein (z.B.
durch eine Systemische Entzündung - siehe Seite: Symptome,
Punkt [23]). Für eine immer wiederkehrende
Erweichung der Blut-Hirn-Schranke kann z.B. Chlamydia
pneumoniae und/oder Borrelia (insbs.
Bb.sl.-Komplex) verantwortlich sein, für den
immer wieder erneuten Kontakt zu Selbst-Antigenstrukturen kommen
wohl vorallem die Borrelien in Frage. Chlamydien
(Chl. pneumoniae) kommen für
einen immer wiederkehrenden Kontakt zum Selbst-Antigenen wohl eher
eingeschränkt in Betracht, da der Selbst-Antigenkontakt nur
auf eine phasenweise Entzündungen der Augen (Retina)
zurückgeführt werden kann. Dort werden durch die
Perforation der Blut-Gefäße vermutlich sogenannte
sequestrierten Proteinen
(isolierte Proteine)
für die Immunabwehr sichtbar, die sonst der Immunabwehr
verborgen bleiben. Der Aufbau der Netzhaut (Retina)
ähnelt im Prinzip dem des Gehirns (ZNS),
wodurch es eventuell zur Fehlausrichtung gegen Gehirnbestandteile
kommen kann. Meiner Meinung nach aber ein eher örtlich
begrenzter Prozess, der nicht unbedingt zu Attacken gegen das ZNS
führen muss. Ich vertrete vielmehr die Meinung, das für
den immer wiederkehrenden Kontakt zu Selbst-Antigenstrukturen die
Borrelien wesentlich privilegierterte Kandidaten sind, da
ihre gesamte Tarnung im wesentlichen auf Maskierung mit zum Teil
Selbst-Antigen-ähnlichen Strukturen aufgebaut ist. So führen
die Borrelien selbst immer wieder zum erneuten Kontakt mit
Selbst-Antigenstrukturen. Zusätzlich kommen die Immunzellen
bei Borreliose eventuelle durch Entzündungen der
Blut-Gefäßen, die ähnlich
in den Augen auftreten können wie beim
Chlamydien-Infekt, mit echten Selbstantigenen
(ontogenetischen
Gewebe u./o. sequestrierten Proteinen) in
Kontakt.
|
|
|
|
|
|
Ins
Detail (insbs. Zusammengetragen aus [10/23/59/61/68/69]):
|
|
|
|
|
|
Im
Mittelpunkt der Immunantwort beim MS-Syndrom stehen T-Zellen,
die mittels spezifischen T-Zell-Rezeptor (TCR)
Antigenstrukturen erkennen, wenn sie von körpereigenen
HLA-identischen Zellen präsentiert werden. Es gibt den
sogenannte HLA-Klasse I Faktor (MHC-Faktor
1) der auf fast allen Körperzellen vorkommt, und
den HLA-Klasse II Faktor (MHC-Faktor 2)
der nur auf sogenannten profesionellen Antigen-präsentierenden
Zellen (Immunzellen) auftritt.
Bei den sogenannten profesionellen Antigen-präsentierenden
Zellen handelt es sich um Makrophagen (Monozyten)
und B-Lymphozyten. Unter bestimmten Bedingungen, z.B. durch
IFN-g und TNF-a
können die HLA-Klasse II Faktoren aber auch auf anderen
Zellen induziert werden (HLA/MHC-Klassen
siehe Seite: Merkblatt, Punkt 44). Die entsprechenden
Zellen werden dann von T-Helferzellen (CD4-positive
T-Zellen) erkannt, wodurch sie in Folge eine entsprechende
Immunantwort auslösen (siehe auch oben,
“dendritische Zellen“).
|
|
|
|
|
|
Unter
Normalbedingungen (gesunder Zustand)
werden im ZNS die HLA-Klasse II Faktoren von den ZNS-Zellen
nicht ausgestülpt, auch die HLA-Klasse I Faktoren erscheinen
eher wenig, ohne die aber Antigene (AG)
von T-Zellen nicht erkannt werden können. Dem kommt
hinzu, dass das ZNS normalerweise durch die Blut-Hirn-Schranke
abgeschottet ist. Die Blut-Hirn-Schranke (o.
Blut-Liquor-Schranke) wird aus einer Endothelzellschicht,
darunterliegender Basalmembran und einem Filz gebildet, welches
aus Fußfortsätzen sogenannter Astrozyten (o.
Sternzelle = Gliazelle mit strahlenförmigen Fortsätzen)
besteht. Als Blut-Hirn-Schranke bezeichnet man den sogenannten
Schrankeneffekt, der in den Kapillar-Gefäße des Plexus
choroidei und den Paechionischen Granulationen der Hirnhäute,
den Hirnwasserraum (Liquorraum) gegen
den Blutkreislauf abgrenzt. Beim "Plexus chorioidei"
(Blutgefäßknäulen)
und den "Paechionischen Granulationen" (zottenartige
Ausstülpungen) handelt es sich um Bereiche, in denen
der Stoffwechselaustausch zwischen Gehirn (Liquor)
und Körper (Blut) stattfindet.
|
|
|
|
|
|
Dank
dieser umfangreichen Schutzmechanismen (Blut-Hirn-Schranke,
keine HLA-Faktor-Ausstülpungen etc.) kann unter
normalen Umständen keine Immunreaktion im ZNS ausgelöst
werden. Die Blut-Hirn-Schranke kann von T-Zellen nur überwunden
werden, wenn sie außerhalb des ZNS (z.B.
im Blut) eine Antigenstruktur erkennen, die in dieser
oder sehr ähnlicher Form im ZNS vorkommt. Auf diese Weise
aktivierte T-Zellen können dann die Blut-Hirn-Schranke
überwinden und ins ZNS einwandern.
|
|
|
|
|
|
Dieser
nötige wiederkehrende Antigene Kontakt zu ZNS-ähnlichen
Antigenstrukturen, ist meiner Meinung nach, insbesondere bei
den Borrelien gegeben (siehe
oben). So darf unter derzeitigen Kentnisstand (Stand
2007) angenommen werden, das durch Borrelien z.B.
Myelin-reaktive T-Zellen (z.B. MBP
reaktiv) aktiviert werden (CD4
T-Zellen). Die Mehrheit der durch Borrelien aktivierten
T-Zellen, die Selbstantigen erkennen, gehören den Klassen CD3
und CD4 an. Der Übertritt ins ZNS erfolgt dann mittels
Adhäsionsmolekülen wie z.B. dem Selektin und dem
sogenannten intrazellulären Adhässionsmolekül
(ICAM-1). Erleichternd für den
Übertritt der T-Zellen kommt wahrscheinlich hinzu, das in den
Gefäßbereichen wo sich Borrelien intrazellulär
zurückgezogen haben, diese die Adhäsionsmloküle
(ICAM / intercellular adhesions molecule)
der befallenen Zellen durch Genregulation unterdrücken. Als
Folge ist eine Schädigung der Gefäßwände oder
der Blut-Hirn-Schranke denkbar.
|
|
|
|
|
|
An
diesem Punkt, der Blut-Hirn-Schranken-Erweichung, könnte eine
Co-Infektion mit Chlamydia pneumoniae eine verstärkende
Wirkung haben, da diese zur Perforation der Blut-Gefäße
führen sollen. Ist aber mit ziemlicher Sicherheit nicht immer
nötig, da die systemische Entzündung durch die Borrelien
alleine reicht um die Blut-Hirn-Schranke aufzuweichen (siehe
auch Seite: Symptome, Punkt [23]).
|
|
|
|
|
|
Durch
die Borrelien-bedingte Runterregulation des ICAM-1 Gens
(intercellular adhesion molecule-1
precursor) können im Blutstrom schwimmende Immunzellen
allerdings nicht an die durch Borrelien befallenen
Endothelzellen der Blut-Gefäße andocken, da die
entsprechende Ankerpunkte nicht von den Endothelzellen ausgestülpt
werden. Ohne diese Ankerpunkte können sich die Immunzellen
nicht an den entsprechenden Endothelzellen (Blutgefäßwände)
halten und ins befallene Gewebe (Infektionsgewebe)
eindringen. Auf diese Weise werden die Immunzellen und
Entzündungsprozesse vermutlich auf die eigentlich nicht
betroffenen Nachbarzellen des Umgebungsgewebes abgelenkt, da bei
ihnen, im Gegensatz zu den befallenen Zellen, das ICAM-1 Gen nicht
runter reguliert ist (siehe Seite:
Merkblatt, Abs.: Tarnstrategien). Die ICAM-1 Gen-Regulation
ist sicherlich ein reiner Selbstschutz der Borrelien, die
mit Sicherheit kein Interesse daran haben in ihren Nischen, z.B.
in den Endothelzelle und hinter der Blut-Hirn-Schranke, von der
Immunabwehr erreicht zu werden.
|
|
|
|
|
|
Da
aber entsprechend aktivierte Myelin-reaktive T-Zellen auch in
gesunden Gefäß-Bereichen ins ZNS übertreten
können, ist die Borrelien-bedingte ICAM-1 Gen
Regulation hierfür wohl weniger von Bedeutung.
|
|
|
|
|
|
Im
ZNS lösen die falsch ausgerichteten autoreaktiven T-Zellen
die Ausschüttung der Zytokine IL-2, IFN-g
und TNF-a aus, was als Folge zur
Ausstülpung von HLA-Klasse-II-Molekülen auf den dort
ansässigen Astrozyten, Mikrogliazellen und eventuell
eingewanderten Makrophagen führt und diese somit zur
Antigenpräsentation befähigt. Dieser Vorgang würde
eine Vermehrung der entsprechende autoreaktiven Immunzellen
induzieren, sowie den Fressvorgang (Phagozytose)
und die Sekretion weiterer Entzündungsmeditatoren
veranlassen. Da hiervon auch die Taktgeber bzw. Synchronisatoren
des Gehirns, die Astrozyten betroffen sind, kann hiermit das
gestörte EEG bei der chronischen Borreliose erklärt
werden. (siehe oben Kap.: Aufbau der
Nerven des ZNS und PNS und Seite: Merkblatt, Kap.: Diagnose, Abs.:
gestörtes EEG). Normalerweise sind z.B. die
Mikrogliazellen für den Schutz der empfindlichen Nervenzellen
(Neuronen) zuständig, aber durch die Aktivierung schütten
auch diese TNF-a aus, der
eine direkte auflösende Wirkung auf die Isolationsschicht der
Nerven ausübt. Bei normaler IFN-g-Konzentration
verhalten sich die Mikrogliazellen nicht auffällig, nur bei
sehr hoher Konzentration [19]. Aber
da es durch die fehlgeleiteten T-Zellen zu erhöhten Werten
unter den Zytokinen IL-2, IFN-g
und TNF-a kommt, werden aus den
ZNS-Schützlingen autoaggressive Zellen. Dies wäre
dann der Initialauslöser welcher zur Autoaggression im ZNS
führt, somit zur Demyelinisierung in und um den betroffenen
Gefäß-Bereichen, die bei entsprechenden Untersuchungen
als Läsionen im bildgebenden MRT-Verfahren erscheinen. Die
Läsionen werden auch MS-Plaque genannt. Die MS-Plaques treten
vorallem im Rückenmark, N. Opticus (Sehnerv)
und in der sogenannten periventrikulären weißen
Substanz (Gefäße umgebend)
auf. In den MS-Plaques sind hauptsächlich T-Lymphozyten
(T-Zellen), Entzündungszellen
und Makrophagen anwesend, allerdings enthalten chronische
MS-Plaques so gut wie keine Zellen mehr [40].
|
|
|
|
|
|
Durch
die oben beschriebene Blut-Hirn-Schrankenstörung
können auch die Borrelien-Galaktolipide
induzierten Antikörper GM1, GD1b u./o. GT1b
vom Blut ins ZNS vordringen, denen dies sonst nicht
gelingen würde. Diese Antikörper sind allesamt
autoreaktive Antikörper, die sich vor allem kreuzreaktiv
gegen die Plasmamembran der Nervenzellen (Gangliosid)
richten. Die angelagerten autoreaktiven Antikörper
aktivieren in der Folge das sogenannten Komplementensystem
(angeborene Immunität), was zu
einer Verstärkung der Entzündungen führt und so mit
zur Schädigung des Myelins beitragen würde
(Demyelisierung bzw. Abbau der Weißen
Substanz). Die Borrelien-Galaktolipide können
aber auch direkt zur Aktivierung von Makrophagen führen,
die dann Entzündungen an den Gliazellen hervorrufen. Bei
circa 60 Prozent der Patienten mit Neuro-Borreliose konnten
anti-MBP IgG Zellen beobachtet werden, unabhängig von der
Phase der Erkrankung. Diese Zellen wurden nur im Hirnwasser
(Liquor) gefunden, nicht im
Blut der Patienten.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die Häufigkeit
der MS-Fälle ein Ergebnis der frühen Diagnose, MS oder
Borreliose?
|
|
|
|
|
|
Vorweg
ein paar allgemeine Daten zur MS-Häufigkeit (Prävalenz),
erfasst in den Ländern die bei der MSIF (multiple
sclerosis international foderation) angemeldet sind [34].
Die nachfolgenden Prävalenzangeben zeigen wie viele
MS-Betroffene auf jeweils 100.000 Pers. der Bevölkerung in
den entsprechenden Ländern kommen.
|
|
|
|
|
|
Länder
mit sehr hoher MS-Prävalenz (> 150/100.000):
|
|
|
|
|
|
Norwegen
(186/100.000), Schweden (170/100.000 - siehe auch unten
Bb.-Prävalenz), Kanada (169/100.000), Irland
(186/100.000), Polen (155/100.000)
|
|
|
|
|
|
Länder
mit hoher MS-Prävalenz (> 100/100.000):
|
|
|
|
|
|
Deutschland
(149/100.000), Großbritannien (145/100.000), Schweiz
(136/100.000), Dänemark (134/100.000), USA (128/100.000),
Belgien (118/100.000), Ungarn (118/100.000), Finnland
(117/100.000), Australien (109/100.000), Island (108/100.000 -
siehe auch unten Bb.-Prävalenz), Frankreich
(103/100.000), Niederlande (103/100.000), Slowakei (102/100.000),
Lettland (100/100.000), Österreich (100/100.000 -
siehe auch unten Bb.-Prävalenz)
|
|
|
|
|
|
Länder
mit mittlerer MS-Prävalenz (> 50/100.000):
|
|
|
|
|
|
Luxembourg
(98/100.000), Tschechien (97/100.000), Italien (87/100.000),
Rumänien (87/100.000), Israel (86/100.000), Griechenland
(76/100.000), Spanien (75/100.000), Neuseeland (67/100.000),
Portugal (50/100.000)
|
|
|
|
|
|
Länder
mit geringer MS-Prävalenz (< 50/100.000):
|
|
|
|
|
|
Türkei
(47/100.000), Zypern (45/100.000), Slowenien (44/100.000 -
siehe auch unten Bb.-Prävalenz), (47/100.000) Argentinien
(29/100.000), Malta (22/100.000), Brasilien (16/100.000), Iran
(20/100.000), Mexiko (16/100.000), Chile (14/100.000), Indien
(5/100.000)
|
|
|
|
|
|
Länder
mit extrem niedriger MS-Prävalenz (< 5/100.000):
|
|
|
|
|
|
Japan
(4/100.000), Südkorea (2/100.000) und Simbabwe (0/100.000)
|
|
|
|
|
|
Stellen
wir jetzt einigen MS-Prävalenzdaten
Lyme-Borreliose-Prävalenzdaten (Bb.-Prävalenz)
gegenüber, so drängt einem der Verdacht auf, dass in
einigen Ländern der gemäßigten Klimazonen die
Ärzte zur jeweiligen Diagnose-Häufigkeit der
entsprechenden Erkrankung (MS-Syndrom o.
Lyme-Borreliose / lowe-dose-borreliosis) beitragen.
|
|
|
|
|
|
Wir
können den MS-Prävalenzdaten natürlich nur
Bb.-Prävalenzdaten aus Ländern gegenüberstellen, in
denen die Lyme-Borreliose bzw. lowe-dose-borreliosis zu den
meldepflichtigen Krankheiten zählt.
|
|
|
|
|
|
Inwieweit
die verschiedenen Gesundheitssysteme auf die Diagnosehäufigkeit
Multiple Sklerose Syndrom (MS)
oder Neuro-Borreliose (NB / C-NB)
Einfluss haben, sei dahin gestellt. Ich möchte an dieser
Stelle nur einmal Slowenien (Slovenija /
SLO) unter den EU-Ländern als Beispiel bringen,
welches anfänglich Schwierigkeiten hatte in die EU
aufgenommen zu werden, weil u.a. deren Sozialsystem als zu teuer
bzw. die Struktur als nicht EU-Konform bewertet wurde. Hier nun
ein Zitat aus [35]: “Und ein
Problem ist auch die gesamte Struktur des Staatshaushalts mit
seinen unverhältnismäßig hohen Ausgaben für
die Finanzierung des Sozial- und Rentensystems, was sowohl von der
Weltbank als auch vom IWF gerügt wurde.“ - Zitatende. In
SLO gab es und gibt es sogenannte Gesundheitszentren und
Polistationen, unter deren Dächern i.d.R. verschiedene Ärzte
tätig waren/sind [F], was
sicherlich mit zu unbefangenen, fachübergreifenden Gesprächen
unter den Ärzten geführt hat und führt, somit
eventuell auch zu einer besseren präventiven Diagnostik.
Zumal in SLO niemand an chronisch erkrankten verdient, sondern
jeder chronisch Kranke das Staatssäckel mehr belastet. In SLO
ist insbesondere die präventive Gesundheit staatlich
abgesichert [F], und der Staat hat
ein möglichst großes Interesse daran die
Arbeitsfähigkeit der Bevölkerung aufrecht zu halten. Es
ist z.B. billiger eine ausreichende Antibiose auf Lyme-Borreliose
durchzuführen, auch wenn die Diagnose eventuell nur auf einen
frühen klinischen Befund (Beginn 1.
Stadium) gestellt werden kann (serologisch
negativ), als z.B. eine lebenslange entzündungshemmende
MS-Therapie (siehe Abs.: Ohne Wort - zum
Nachdenken). Die Prävalenzdaten aus SLO stammen aus
dem Jahr 1997, also noch aus der Zeit bevor das ehemalige
sozialistische jugoslawische Land den EU-Beitritt feiern durfte.
In Deutschland gab es nur in der ehemaligen Deutschen
Demokratischen Republik (DDR) die
Meldepflicht für die Lyme-Borreliose, in den ehemaligen
Ländern der Bundesrepublik Deutschland (BRD)
nicht. Diese Meldepflicht wurde i.d.R. von den “neuen“
deutschen Bundesländern (ehem. DDR)
auch heute noch beibehalten, ohne dessen Statistik man keinerlei
aussagekräftige Bb.-Prävalenzdaten in Deutschland hätte.
|
|
|
|
|
|
Anders
als z.B. in SLO sieht es sicherlich in den Ländern aus wo die
Kranken, bzw. die Arbeitsunfähigen, aus verschiedenen Kassen
bezahlt werden. Multiple Sklerose ist ein Syndrom und gilt bei uns
in Deutschland i.d.R. nicht zu den Erkrankungen die im Beruf
erworben werden können, Lyme-Borreliose hingegen schon. In
Ländern wo die Kosten auf verschiedene Geldgeber (Kassen)
aufgeteilt werden, z.B. gesetzliche Krankenkassen, private
Krankenkassen, Berufsgenossenschaften, Sozialkassen etc. geht es
um Kostenteilung, Kostenabweisungen und um den Gewinn
entsprechender Einrichtungen (z.B. Kliniken)
und Berufsgruppen (z.B. Fachärzte).
|
|
|
|
|
|
Das
Kosten und Kostenübernahme häufig eine Schlüsselrolle
bei der Borreliosediagnostik inne haben, darf ich dank Feedbags
auf meine Homepage immer wieder feststellen. Bei
privatversicherten Patienten wird häufig eine wesentlich
umfangreichere klinische und serologische Diagnostik in Bezug auf
Borreliose durchgeführt, als z.B. bei den regulär
pflichtversicherten Patienten.
|
|
|
|
|
|
Man
ist natürlich bestrebt einen verbindlichen “Goldstandard“
für die Diagnostik zu finden, da es ja auch um rechtlich
Belange bei jeder Behandlung geht. Gelingt es den entsprechenden
Stellen einen Diagnose-“Goldstandard“ in Bezug auf
Borreliose einzuführen, wird dieser als rechtswirksam
festgeschrieben, so ist dieser bindend für eine anerkannte
Diagnostik. Hat dann ein Arzt z.B. alle
“Goldstandard“-Diagnosepunkte der Borreliose abgehakt,
braucht er in der Folge keine Klagen auf Fehldiagnose fürchten
- das bei einer Erkrankung dessen Diagnostik die bekannten
Schwierigkeiten aufweist und ggf. zur Autoaggressionserrankung
führt.
|
|
|
|
|
|
Das
käme dem gleich als wenn man sagen würde, nur Kfz z.B.
mit Fulda-, Michelin oder Contireifen sind Autos. Alle Kfz. bei
denen keine solche Bereifung nachgewiesen werden kann, sind auch
nicht als Autos einzustufen. Das wäre doch auch ein schöner
Goldstandard um festzulegen was ein Auto ist, und was nicht -
oder?
|
|
|
|
|
|
Doch
jetzt zu der Gegenüberstellung der Prävalenzindizraten
von Multiple Sklerose (MS) und
Lyme Borreliose / low-dose-borreliosis (Bb.).
Natürlich ist mir klar das der Vergleich ein wenig hinkt,
aber ein Funken Wahrheit enthält er wohl schon. So fällt
einem auf, dort wo das Gesundheitssystem mehr basissozial, über
eine Kasse geregelt wird, ist die MS-Prävalenzrate fast
identisch niedriger (A 54,4 % / SLO 55,8 %) trotz geographisch
prädestinierter Lage für Multiple Sklerose (MS).
Die Gesundheitssystem von Österreich (A)
und Slowenien (SLO) sind sich z.B. sehr ähnlich [36],
dies könnte die ähnlich niedrige MS-Prävalenzrate
der beiden Länder erklären obwohl dessen Volksgruppen
ebenso stark für MS prädestiniert sein sollten wie z.B.
Deutschen.
|
|
|
|
|
|
Aus
der Rolle rutscht in dieser Gegenüberstellung Island. Da die
Gesundheitsfürsorge Islands vorrangig staatlich finanziert
wird (85 % aus Steuern, 15 % aus Zuzahlung
des Patienten), und alle Arten der Gesundheitsleistungen
umfasst [38], sollte man nach meiner
Präventionsthese dort ähnliche Ergebnisse bzgl. MS- und
Bb.-Verhältnis-Prävalenzdaten erhalten wie in A und SLO.
Wie der Ausrutscher zu bewerten ist, schlechte Bb.-Diagnose und
Behandlung, ein weiterer MS-Erreger (z.B.
Chlamydien) oder stärkere Prädisposition
der Bevölkerung, die Frage bleibt wohl offen [G].
|
|
|
|
|
|
Auch
bei den Schweden sollte man nach meiner These (sofern
sie zutrifft) eigentlich ein anderes Ergebnis erwarten, da
deren Gesundheitssystem staatlich finanziert wird. So würde
man auf den ersten Blick natürlich auch eine bessere
präventive medizinische Versorgung erwarten, dies muss
sicherlich aber differenziert betrachtet werden. In Schweden
geschieht jede gesundheitliche Fürsorge erst einmal auf der
Basis der Eigenfinanzierung, erst ab einer staatlich festgelegten
Obergrenze bekommt der Betroffene (Patient)
einen Zuschuss. Ab einer gewissen Obergrenze braucht der Patient
dann gar nicht mehr zu zahlen [39].
Dies System kann eventuell dazu führen, das jemand der von
einer Zecke gestochen wurde nicht gleich wegen z.B. leicht
erhöhter Temperatur (schwaches Fieber)
zum Arzt geht. Auf diese Weise gelangen dann vielleicht
hauptsächlich nur die chronischen Borreliosefälle zum
Arzt, bei denen wegen der bekannten diagnostischen Schwierigkeiten
bzgl. Borreliose dann eventuell die Diagnose Multiple Sklerose
gestellt wird und nicht Borreliose.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gegenüberstellung
der Prävalenzdaten Multiple Sklerose und Lyme-Borreliose /
low-dose-borreliosis
|
|
|
|
|
|
In
der Tabelle sind die Prävalenzindizraten immer bezogen auf
100.000 Einwohner des jeweiligen Landes dargestellt
|
|
|
|
|
|
Land
|
MS-Prävalenzrate
[34]
|
Differenz
in % (b)
|
Bb-Prävalenzrate
[37]
|
MS/Bb.-Präval.
|
|
|
|
|
|
Deutschland
|
149/100.000
|
34,8
mehr MS
|
72/100.000
(a)
|
221/100.000
|
|
|
|
|
|
Island
|
108/100.000
|
98,9
mehr MS
|
0,6/100.000
|
108,6/100.000
|
|
|
|
|
|
Österreich
|
100/100.000
|
54,4
weniger MS
|
340/100.000
(Schnitt)
|
440/100.000
|
|
|
|
|
|
Schweden
|
170/100.000
|
42,3
mehr MS
|
69/100.000
|
239/100.000
|
|
|
|
|
|
Slowenien
|
44/100.000
|
55,8
weniger MS
|
155/100.000
|
199/100.000
|
|
|
|
|
|
(a)
- für Deutschland kann in dieser Tabelle nur als relativ
verlässliche Bb.-Prävalenzdaten die Zahlen aus
Brandenburg angesetzt werden, da nur hier längerfristig
flächendeckend die Prävalenz-Erfassung erfolgte.
|
|
|
|
|
|
(b)
- Berechnungsbeispiel an den Daten von Deutschland: 149
(MS-Prävalenz) + 72 (Bb.-Prävalenz) = 221 (Gesamt
MS/Bb.-Prävalenz / = 100 %)
Þ 149
(MS-Prävalenz) - 72 (Bb.-Prävalanz) = 77 (Differenz
MS/Bb.-Prävalenz / = 34,84 %)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ohne Worte - zum
Nachdenken:
|
|
|
|
|
|
Zitat aus [13]:
>>Patienten der Interferon-Gruppe erlitten während
der Behandlungsdauer von zwei Jahren durchschnittlich 0,6
MS-Schübe pro Jahr und damit ein Drittel weniger als die
Patienten der Placebo-Gruppe (0,9 MS-Schübe pro Jahr). Das
Ergebnis bestätigt die Betaseron-Studie.<<...
...>>Trotz der guten Ergebnisse warnt Hohlfeld:
„Beta-Interferon bietet keine Heilung. Es hält nicht
einmal den Status quo des Patienten, sondern bremst lediglich den
weiteren Verlauf der Krankheit – ein bescheidenes Ziel,
allerdings eines, das bisher kein anderes MS-Medikament so
überzeugend erreichen konnte.<<... ...>>Diese
Frage beschäftigt indes nicht nur Patienten, sondern auch die
drei Beta-Interferon-Anbieter, die mit ihren Produkten einen Markt
anpeilen, den Finanzexperten für 1998 auf 1,4 Milliarden
US-Doller taxieren.<<... ...>>Diese Zahl macht einen
weiteren neuralgischen Punkt der MS-Therapie mit Beta-Interferon
deutlich: die hohen Kosten. In den USA kostet die Behandlung eines
MS-Kranken mit Beta-Interferon pro Jahr 10.000 US-Dollar „Zirka
30.000 Patienten [C]“
so Schering-Sprecherin Monika Klutz-Specht, „sind derzeit in
den USA in Behandlung.“ Damit ergeben sich dort Kosten von
rund 300 Millionen US-Dollar. Wenn sich in Deutschland nur ein
Viertel der rund 120.000 MS-Kranken [C]
zukünftig mit Beta-Interferon behandeln
lassen sollten,... ....so würden nach einer Berechnung des
Neurologen Prof. Dietmar Seidel vom Augustahospital in Anholt auf
Krankenkassen und Patienten Kosten von rund 500 Millionen Mark
zukommen. Auch Seidels Münchner Kollege Hohlefeld sieht das
Dilemma: „Wir haben es mit einer häufigen Erkrankung und
einem extrem teuren Medikament zu tun.“<<
|
|
|
|
|
|
Anmerkung: selbst
wenn nur ein Drittel der MS-Patienten auf
eine Infektion mit Borrelien zurückzuführen
sind, würde eine ursächliche frühe präventive
Behandlung mittels Antibiose, setzt man die im Jahr 1998
angepeilten 1,4 Milliarden US-Doller zugrunde, circa 466millionen
US-Dollar (= ca. 317millionen EUR / Kurs 17.11.2007)
einsparen. Das wären bei uns in Deutschland
(Stand 2007) ca. 12.7millionen
Zeckenuntersuchungen auf Borrelien und 2,64millionen
Zeckenuntersuchungen [a]
inclusive anschließender zweiwöchiger präventiver
Antibiose - sofern die Antibiose überhaupt wegen
positivem Borrelien-Befund nötig wäre.
|
|
|
|
|
|
Gehen wir nun
von 55tausend (= Schnitt / 50.000 nach
[88]
60.000 nach [89])
Borreliose-Neuinfektionen pro Jahr aus und von einer
Borrelien-Übertragungsrate von 3,8 Prozent [b],
dann ergibt dies, dass man
mit diesen riesigen Betrag circa 8,5 Jahre [c]
lang alle abgezupften Zecken auf Borrelien untersuchen
könnte - inclusive präventiver Antibiose ergibt
sich ein Wert von circa 1,5 Jahre
[d].
Betrachtet man nun die Zeckenuntersuchungen zusammen mit den
anschließend nötigen präventiven
Antibiotika-Therapien, die bei circa 3,8 Prozent der Patienten
angebracht wäre, ergibt sich das mit der gigantischen
Summe von 317millionen EUR
circa 7,5 Jahre [e]
Borreliose-Patienten durchgreifend
medizinisch versorgt werden könnten.
|
|
|
|
|
|
|
|
|
|
|
|
[a]
- ca. 25 EUR (Zeckenuntersuchung) + ca. 70 EUR (Arztbesuch) + ca.
25 EUR (3 x Doxycyclin) = ca.
120 EUR
|
|
|
|
|
|
[b]
- (berechnet nach [87]):
durchschnittliche Borrelien-Durchseuchungsrate der Zecken beträgt
15 Prozent *, und die maximale Borrelien-Durchseuchungsrate der
Zecken in Hochendemiegebieten beträgt 40 Prozent **. Daher
muss davon ausgegangen werden, dass jeder zehnte Zeckenstich ***
zu einer Borreliose führt.
|
|
|
|
|
|
Berechnung:
40% ** : 15% * = Faktor 2,6 / 10 *** : 2,6 = 3,8 % der
Zeckenstiche führen ca. im Schnitt zur Borrelien-Infektion
|
|
|
|
|
|
[c]
- 55.000 : 3,8 = 14.473 / 14.473 x 100 = 1.447.300 Zeckenstiche
gesamt pro Jahr in der BRD / 12.700.000 : 1.447.300 = 8,77
Jahre
|
|
|
|
|
|
[d]
- 55.000 : 3,8 = 14.473 / 14.473 x 100 = 1.447.300 Zeckenstiche
gesamt pro Jahr in der BRD / 2.640.000 : 1.447.300 = 1,82 Jahre
|
|
|
|
|
|
[e]
- 3,8 % der Patienten würden eine präventive Antibiose
benötigen. 120 EUR x 3,8 % = 380 EUR (pro 100 Patienten) / 25
EUR x 96,2 % = 2405 EUR (pro 100 Patienten) / 2405 EUR + 380 EUR =
2785 EUR Gesamtkosten für 100 Patienten / Kosten pro Patient
im Schnitt = 27,85 EUR / 317.000.000 EUR : 27,85 EUR = 11.382.405
Zeckenuntersuchungen insgesamt incl. benötigter präventiver
Antibiose. 11.382.405 Zeckenuntersuchungen : 1.447.300
Zeckenstiche pro Jahr in der BRD = 7,86 Jahre
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Quellen,
Info und weiterführende Kurz-Erklärungen:
|
|
|
|
|
|
[1]
- Rüttinger,
H. (1994): Multiple Sklerose,
Information und Ratschläge, Serien Gesundheit, Piper / C &
H, Band 1936, Verl. Pieper München / Chapman und Hall
Weinheim, J. 94, ISBN 3-492-11936-0
|
|
|
|
|
|
[2]
- Oschmann, P.,
Hornig, C., Dorndorf, W. (1993): Die
zerebrovaskuläre Neuroborreliose, Aktuelle Neurobiologie,
Verl. Georg Thieme Verlag - Stittgart, H 6, S. 203-206, J. 12/93
|
|
|
|
|
|
[3]
- Delank, H.-W.
(1991): Neurologie, 6. Neu
bearbeitete und ergänzte Aufl., Verl. Ferdinand Enke Verl.,
J. (78) 91, ISBN 3-432-89916-5
|
|
|
|
|
|
[4]
- bdw Red. (2006): Multiple Sklerose – Ist ein Virus
schuld?, medinfo – Aktuelles aus der Medizin, bild der
wissenschaft, Verl. Konradin Medien GmbH, bild der wissenschaft,
S. 39, 10/06
|
|
|
|
|
|
[5]
- Schiller, E.
(2002): Lyme-Borreliose im Krankengut der Kinderklinik Rosenheim
von Mai 1996 bis April 1998 unter besonderer Berücksichtigung
serologischer Aspekte, Dissertation, Aus der Klinik für
Kinderheilkunde und Jugendmedizin des Klinikums Rosenheim -
Lehrkrankenhaus der Ludwig-Maximilians-Universität München,
Medizinische Fakultät der Ludwig-Maximilians-Universität
zu München
|
|
|
|
|
|
[6]
- Gatermann, S.
(2002): Untersuchungsprogramm, Medizinaluntersuchungsamt –
Universitätsinstitut, institut für Medizinische
Mikrobiologie der Stadt Bochum
|
|
|
|
|
|
[7]
- Uebermuth, C. (2005): Neue Erkenntnisse zur Pathogenese
der multplen Sklerose - Potenzial für die Erweiterung der
therapeutischen Option: Multiple Sklerose - eine
Zeckenbisserkrankung ?, Medizin, Deutsches Ärzteblatt print,
Diskussion zu den Beitrag von Prof. Dr. med. Ralf Gold, Jun. Prof.
Dr. med. Christine Stadelmann, Dr. med. Ralf Linker, Dr. med.
Ricarda Diem, Prof. Dr. med. Mathias Bähr, Prof. Dr. med.
Wolfgang Brück in Heft 17/2005, Deutsches Ärzteblatt
102, Ausgabe 42 vom 21.10.2005, Seite A-2879 / B-2432 / C-2292
|
|
|
|
|
|
[8]
- Hallricher, K. (2007): 5. Wie altert das Gehirn? Früher
dachte man, das Gehirn verfiele mit den Jahren. Aber die Sache ist
komplizierter., Die 7 Rätsel der Hirnforschung, Leben &
Umwelt, Bild der Wissenschaft, Verl. Deutsche Verlags-Anstalt GmbH
- Stuttgart, S.32-33, J. 1/07
|
|
|
|
|
|
[9]
- Kamradt, T. (2002): Aktivierung und Differenzierung von
T-Lymphozyten durch Infektion und Autoimmunität, 4.1
Aktivierung von Th-Zellen bei Infektion und Autoimmunität:
Molekulare Mimikry als Ursache für Autoimmunität ?, S.
22,
http://edoc.hu-berlin.de/habilitationen/kamradt-thomas-2001-05-29/HTML/kamradt-ch4.html
|
|
|
|
|
|
[10]
- Hamid, H.M. (2000): Lipide von Borrelia burgdorferie,
Inangural-Dissertation, Zentrum für Medizinische
Mikrobiologie und Virologie, Institut für Medizinische
Mikrobilologie d. Justus-Liebig-Universität Giessen
|
|
|
|
|
|
[11]
- Marr-Bieger, L. (2002), Die Slowenen, Geschichte der
Republiken, Slowenien-Istrien, 4. Aufl., Verl. Michael Müller
Verlag Erlangen, S. 112-113, ISBN 3-923278-77-2
|
|
|
|
|
|
[12]
- Brunner, M., Stein, S., Mitchell, P.D., Sigal, L.H.
(1998): <literatur/immunecx.htm>
|
|
|
|
|
|
[13]
- Zell, R.-A. (1995): Teure Hoffnung / Erfolg in der
Behandlung von Multipler Sklerose. Gute Nachrichten füe
120000 Multiple-Sklerose-Kranke in Deutschland: Gleich drei
internationlae Studien haben gezeigt, dass Beta-Interferon den
Verlauf der nervenzerstörenden Krankheit bremsen kann. Der
Preis: jährlich 500 Millionen Mark., Medizin, bild der
wissenschaft, S. 46-50, Febr. 1995
|
|
|
|
|
|
[14]
- Haes, J. A. C. (2003): Generierung eines rekombinanten
Immunoblots als Bestätigungstest einer Infektion mit Borrelia
burgdorferi, Dissertation, Fachbereich Medizin der Universität
Hamburg
|
|
|
|
|
|
[15]
- Diaz, E., Papa, A., Vezyri, E., Tsounis, S., Milonas, I.
u. Antoniadis, A.): Borrelia valaisiana in cerebrospinal fluid,
Emerging Infections Diseases, Sep. 2004,
www.findarticles.com/p/articles/mi_m0GVK/is_9_10/ai_n6211054
|
|
|
|
|
|
[16]
- Foldvari, R., Farkas, R. u. Lakos, A. (2005): Borrelia
spielmanii erythema migrans, Hungary, Emerging Infections
Diseases,
www.findarticles.com/p/articles/mi_m0GVK/is_11_11/ai_n15796075
|
|
|
|
|
|
[17]
- MacDonald, A, B (2006): Dementia caused by Borrelia
infection of the Central Nervous System, Columbia University LDA
National Scientific Meeting, Philadelphia Pennsylvania, 20.10.2006
|
|
|
|
|
|
http://www.molecularalzheimer.org/files/Final_version_Philadelphia_Presentation.pdf
|
|
|
|
|
|
[18]
- WissenDigital (2002): Autoimmunerkrankungen, InfoThek
2002 – Medizin Lexikon, Sonderausgabe, Verl. Tandem Verlag
GmbH
|
|
|
|
|
|
[19]
- Lehnen-Beyel, I. (2006): Erkrankte Väter vererben
Multiple Sklerose häufig als Mütter, News, Medizin,
ddp/wissenschaft.de, 25.07.2006,
www.wissenschaft.de/wissenschaft/news/262708.htm
|
|
|
|
|
|
[20]
- JournalMed (2007): Studie erklärt warum mehr Frauen
an Multipler Sklerose erkranken, Infos für Ärzte,
06.02.2006, www.journalmed.de/newsview.php?id=11361
|
|
|
|
|
|
[21]
- eb (2006): Virtuelles Rennen unterstützt Kinder mit
MS, Medizin, Gehirn & Nerven, Multiple Sklerose, Ärzte
Zeitung, 24.10.2006,
www.aerztezeitung.de/docs/2006/10/24/190a1201.asp?cat=/medizin/gehirn_nerven
|
|
|
|
|
|
[22]
- Eberle, U. (2006): Warum Teenager so hirnrissig sind /
Teenager sind seltsam - aus triftigen Grund: All die Jahre, in
denen wir uns das erste Mal verlieben und über so wichtige
Dinge entscheiden wie unseren Beruf, ist unser Gehirn sehr
instabil., bild der wissenschaft, Verl. Konradin Medien GmbH, bild
der wissenschaft, S. 30-34, 2/06
|
|
|
|
|
|
[23]
- Wilke, C. (2003): Serum-Spiegel pro- und
antiinfalmmatorischer Zytokine bei Multiple Sklerose-Patienten
unter Interferon-b 1b-Therapie,
Dissertation, III. Med. Klinik, Technische Universität rechts
der Isar
|
|
|
|
|
|
[24]
- ner (2003): Multiple Sklerose: eine Erkrankung, “die
nie schläft“, Multiple Sklerose, Gehirn & Nerven,
Medizin, Ärzte Zeitung, 06.08.2003,
www.aerztezeitung.de/docs/2003/08/06/146a1302.asp?cat=/medizin/gehirn_nerven
|
|
|
|
|
|
[25]
- Soulas, P., Woods, A., Janlhac, B., Knapp, A.-M.,
Paspuali, J.-C., Martin, T. u. Korganow, A.-S. (2005):
Autoantigen, innate immunity, and T cells cooperate to break B
cell tolerance during bacterial infection, JCI / J. clin. Invest.,
115: 2257-2267 (2005).doi: 1172/JCI 124646,
www,jci.org/cgi/content/abstarct/115/8/2257
|
|
|
|
|
|
[26]
- Lehmitz, R., Höppner, J., Beck, R., Potemkowski, A.
u. Benecke, R. (1997): Liquorveränderungen bei Patienten mit
Neuritis nervi optici - Prognostische Bedeutung?, 4.
Liquor-Symposium - Leipzig, DGLN / Deutsche Gesellschaft für
Liquordiagnostik und Klinische Neurochemie
|
|
|
|
|
|
[27]
- Spitner, S., Lehmitz, E. (1997): Stellenwert von
erregerspezifischen Antikörpersynthesen für die
Diagnostik von neurologischen Erkrankungen, 4. Liquor-Symposium -
Leipzig, DGLN / Deutsche Gesellschaft für Liquordiagnostik
und Klinische Neurochemie
|
|
|
|
|
|
[28]
- Linke, E., Zimmermann, K. (1997): Die „MRZ-Reaktion“
in der Routinediagnostik der Enzephalomyelitis disseminata, 4.
Liquor-Symposium - Leipzig, DGLN / Deutsche Gesellschaft für
Liquordiagnostik und Klinische Neurochemie
|
|
|
|
|
|
[29]
- Schleuning, M., Heinemann, V. (2004): Virustatische
Prophylaxe und Therapie, Manual - Supportive Maßnahmen und
symptomorientierte Therapie, ã
2001 by Tumorzentrum München,
www.krebsinfo.de/ki/empfehlung/supportiv/732-04-Schleuig-pdf
|
|
|
|
|
|
[30]
- www.rki.de Þ
Infektionskrankheiten A-Z Þ
Masern / Röteln / Varzillen - Herpes Zoster / Lyme-Borreliose
|
|
|
|
|
|
[31]
- www.ulga.niedersachsen.de Þ
Masern
|
|
|
|
|
|
[32]
- www.fwiegled.de/roeteln.htm
|
|
|
|
|
|
[33]
-
www.medizin.uni-Koeln,de/projekte/gfv/24Haut-Schleimhaut0406.pdf
|
|
|
|
|
|
[34]
- http://home.link.de/ms-alternativen/htnl/Artikel/html Þ
Bezug: www.msif.org/de/about_mdif/
|
|
|
|
|
|
[35]
- Petelin, S. (1998): Slowenien, Slowenien auf dem Weg in
die EU - noch etliche Hausaufgaben zu erledigen, Zwei
Maastricht-Kriterien würde das kleine Land bereits erfüllen,
bei seiner Gesetzgebung ist es von den EU-Anforderungen allerdings
noch weit entfernt, SZ-Ländere, Beilage der Südeutschen
Zeitung Nr. 154, Mittwoch, 8. Juli 1998
|
|
|
|
|
|
[36]
-
www.aok-bv.de/presse/presseservice/psgpolitik/Index_02869.html
|
|
|
|
|
|
[37]
- www.diss.fu-berlin.de/2006/374/1.pdf
|
|
|
|
|
|
[38]
-
http://ec.europa.eu/employment_social/missoc/2002/03/iceland_de.pdf
|
|
|
|
|
|
[39]
-
http://ec.europa.eu/employment_social/missoc/2002/03/sweden_de.pdf
|
|
|
|
|
|
[40]
- Mitrovic, B., Stock, G., Daniel Perez, H. u. Dinter, H.
(1999): Molekulare Aspekte der Behandlung der Multiplen Sklerose,
Erkrankungen des Zentralnervensystems, Handbuch der molekularen
Medizin, Band 5, Hrsg. Ganten, D., Ruckpaul, K., Springer-Verlag
Berlin Heidelberg, www.springeronline.com&Shortcut
|
|
|
|
|
|
[41]
- Wheldon, D. (2005): Empirical antibacterial treatmant of
infection with Chlamydophila pneumoniae in Multiple Sklerose, In
what other conditions may chlamidial vasculitis be implicated?
Startseite/URL:
www.davidwheldon.co.uk/ms-treatment.html#anchor15516
|
|
|
|
|
|
[42]
- Carreivo, M.M., Laux, D.C. u. Nelson, D.R. (1990):
Characterization of the heat shock response and identification of
heat shock protein antigens of Borrelia burgdorferi, Department of
Microbiology, University of Rhode Island, Kingston 02881, Infect
Immun, 7/90;58(7)2186-91
|
|
|
|
|
|
[43]
- Punchner, A.R., Delaney, E., O´Neil, T. u. Major,
E. (1995): Inoculation of nonhuman primates with the N40 strain of
Borrelia burgdorferi leads to a model of Lyme neuroborreliosis
faithful tu the human disease, Gergetown University Medical
Center, Washington DC., Neurology 1/95;45(1):165-72
|
|
|
|
|
|
[44]
- Koch, M. (2004): Transendotheliale Migration Chlamydia
pneumoniae infizierter Monozyten in einem in vitro Modell der
Gefäßwand, Inauguraldissertation, Medizinische
Fakultät, Universität Lübeck
|
|
|
|
|
|
[45]
-
www.rki.de/eln_049/nn_196658/DE/Content/Infekt/EpidBult/Merkblaetter/Rat__Chlamydia__Teil2.html
|
|
|
|
|
|
[46]
- Groth, H. (2007): Sieg gegen Masern, Kurz und bündig,
Science-Park, Verl. Konradin Medien GmbH, bild der wissenschaft,
S. 7, 04/07, ISSN 0006-2375
|
|
|
|
|
|
[47]
- Stille, W., Stephan, C. (1999):
Chlamydien-Hypothese bei Multipler Sklerose, Mögliche
Auslöser der multiplen Sklerose, Infektionskrankheiten des
Nervensystems, Kongressbericht, Medizin, Deutsches Ärzteblatt
96, H. 45, 12. Nov. 1999, A-2906,
www.ärzteblatt.de/v4/archiv/pdf.asp?d=19913
|
|
|
|
|
|
[48]
- Lux, A.W. (2002): Nachweis von Chlamydia pneumoniae bei
Patienten mit atherosklerotischen Erkrankungen,
Inaugural-Dissertation, Institut für Medizinische
Mikrobiologie und Hygiene, Abt. Mikrobiologie und Hygiene der
Albert-Ludwigs-Universität Freiburg i. Br.,
www.freidok.uni-freiburg.de/volltext/638/pdf/Dissalexlux.pdf
|
|
|
|
|
|
[49]
- HAIN-LIFESCIENCE (2007):
www.hain-lifesience.de/pdf/chlamydien_det.pdf
|
|
|
|
|
|
[50]
- www.medizin-forum.de/prostatitis/icd.html
|
|
|
|
|
|
[51]
- Rühle, H.-J. (200?): Chlamydia pneumoniae und
Multiple Sklerose - Zusammenhang MS und Chlamydien wiederlegt?,
ein Update, Chlamydia News, medac Diagnostika,
www.medic.de/data/diagnostik/chlamydianews/13.pdf
|
|
|
|
|
|
[52]
- Schwarz, C. (2005): Ibhibition von Apoptose in
menschlichen Zellen durch Infektion mit Chlamidia pneumoniae,
Dissertation, Institut für medizinische Mikrobiologie,
Immunologie und Hygiene der Technischen Universität München,
Klinikum rechts der Isar
|
|
|
|
|
|
[53]
- Oschmann, P., Hornig, C., Dorndorf, W. (1993): Die
zerebrovaskuläre Neuroborreliose, Aktuelle Neurobiologie,
Verl. Georg Thieme Verlag - Stittgart, H 6, S. 203-206, J. 12/93
|
|
|
|
|
|
[54]
- Meyer, R. (2002): Multiple Sklerose: Frühdiagnose
mit Kernspintomographie, Deutsches Ärzteblatt 99, Ag. 11, S.
A-673 / B-594 / C-517, 15.03.02,
www.aerzteblatt.de/v4/archiv/artikel.asp?id=30753
|
|
|
|
|
|
[55]
- www.borreliose-berlin.de/druckversion/wilskeschielke.pdf
|
|
|
|
|
|
[56]
- Alaedini, A., Norman, L. (2005):
www.lymenet.de/shgs/corryw/IMMUNOspA-AKKreuzreak.pdf
|
|
|
|
|
|
[57]
- Mathiesen, T., von Holst, H., Fredrikson, S., Wirsén,
G., Hederstedt, B. (1989): Total, anti-viral, and anti-myelin IgG
subclass reactivity in inflammatory disease of the central nervous
system, Department of Virology, National Bacteriological
Laboratory, Stockholm, Schweden, J. Neurol, 236(4): 238-42, PMID:
2760636(#4), PubMed-indexed for MEDLINE
|
|
|
|
|
|
[58]
- Fung, B.-P., McHugh, G.-L., Leong, J.-M., Steere, A.-C.
(1994): Humoral immune response to outer surface protein C of
Borrelia burgdorferi in Lyme disease: role of the immunoglobulin M
respouse in the serodiagnosis of early infection., Division of
Rheumatology / Immunology, New England Medical Center, Boston,
Massachusetts, Infect Immun, 6288): 3213-21, PIMD: 8039891,
PubMed-indexed for MEDLINE
|
|
|
|
|
|
[59]
- Garcia,-Monco, J.-C., Seidman, R.-J., Benach, J.-C.
(1995): Experimental immunization with Borrelia burgdorferi
induces development of antibodies to gangliosides, Deparment of
Neurology, Hospital de Galdacano, Vizcaya, Spain, Infect Immun,
63(10): 4130-7, PMID: 7558329, PubMed-indexed for MEDLINE
|
|
|
|
|
|
[60]
- Hamid, H.M. (2000): Lipide von Borrelia burgdorferie,
Inangural-Dissertation, Zentrum für Medizinische
Mikrobiologie und Virologie, Institut für Medizinische
Mikrobilologie d. Justus-Liebig-Universität Giessen
|
|
|
|
|
|
[61]
- Pohl-Koppe, A., Logigian, E.-L., Steer, A.-C., Hafler,
D.-A. (1999): Cross-reactivity of Borrelia buurgdorferi and myelin
basic protein-specific T-cells is not observed in borrelia
encephalomyelitis, Center of Neurologie Disease, Brigham and
Woman´s Hospital, Boston, Massachusetts, USA, PMID:
10357888(#2), PubMed-indexed for MEDLINE
|
|
|
|
|
|
[62]
- Manniche, V.S. (1993): 1,2 Millionen Deutsche leiden
unter Gelenkrheuma >>Das falsche Feindbild macht krank<<
Rheuma ist eine schlimme Volkskrankheit. Noch legen die Ursachen
im Dunkeln. Klar ist, was die schmerzhaften Gelenkschäden
hervorruft: Ein fehlgeleitetes Immunsystem, das gegen Freund und
Feind gleichermaßen losschlägt., Illustrierte
Wissenschaft, Verl. Bonnier Publication A/S Filiale Norderstedt,
S. 34-37, J. 7/93
|
|
|
|
|
|
[63]
- Dai, Z., Lackland, H, Maßkrug, S., Li, Q.,
Radziewicz, R., Willians, S., Sigal, L.-H. (1993): Molecular
mimicry in Lyme disease: monoclonal antibody H9724 to B.
burgdorferi flagellin specifically detects chaperion-HSP 60.,
Brochim Biophys Acta 1993, Mar 24, 1181(1): 97-100, Center for
Advanced Biotechnology and Medicine, Piscataway, NJ
|
|
|
|
|
|
[64]
- Fritzsche, M. (11/2002): Geographical and seasonal
correlation of multiple sclerosis to sporadic schizophrenia,
http://www.ij-healthgeographics.com/content/1/1/5
|
|
|
|
|
|
[65]
- Fritzsche, M. (11/2002): Seasonal correlation of sporadic
schizophrenia to Ixodes ticks and Lyme borreliosis,
http://www.ij-healthgeographics.com/content/1/1/2
|
|
|
|
|
|
[66]
- www.med.uni-bonn.de/giftzenrale/lyme.html
|
|
|
|
|
|
[67]
- www.gifte.de/Gifttier/erkrankungen_durch_Zecken.htm
|
|
|
|
|
|
[68]
- Baig, S., Olsson, T., Höjeeberg, B., Link, H.
(1991): Cells secreting anti-bodies to myelin basic protein in
cerebrospinal fluid of patients with Lyme neuroborreliosis,
Department of Neurology, Karolinska Institutet, Huddrige
University Hospital, Stockholm, Schweden, Neurology, 41(4): 581-7,
PMID: 1707148(#4), PubMed-indexed for MEDLINE
|
|
|
|
|
|
[69]
- Martin, R., Ortlauf, J., Sticht-Groh, V., Bogdahn, U.,
Goldmann, S.-F., Mertens, H.-G. (1998): Borrelia burgdorferi -
specific and autoreaktive T-cell lines from cerebrospinal fluid in
Lyme radiculomyelitis, Ann Neurol 1988, Oct. 24(4): 509-16,
Department of Neurology, Universität of Würzburg, FRG,
http://actionlyme.org/BIOMARKERS.htm
|
|
|
|
|
|
[70]
- Gute, C.-D., Jager, H.-R. (2002): Contrast enhancement of
the cerebrospinal fluid on MRI in two cases of spirochaetal
meningitis, Lysholm Radiological Department, Nationl Hospital for
Neurology and Neurosurgery, London,UK
|
|
|
|
|
|
[71]
- Chabot, R.-J., Sigal, L.-H. (1995): QEEG and evoked
potentials in central nervous system Lyme disease,
Electroencephalogr., 7/95, 26(3): 137-45
|
|
|
|
|
|
[72]
- Zebandt, S. (2001): Etablierung und Evaluierung zweier
IgG Subklassen - ELISA für die Borreliose - Diagnostik beim
Menschen, Dissertation, Zentrum für Neurologie und
Neurochirurgie, Justus-Liebig-Universität Gießen,
http://geb.uni-giessen.de/geb/volltext/2001/444/pdf/d010046.pdf
|
|
|
|
|
|
[73]
- Mutz, D. (2004): Identifizeierung von Bindungspartnern
des cytosolischen Teils a3-Integrin-Untereinheit
und die Aufklärung ihrer Rolle bei der Funktion der
a3b1-Integrins, Dissertation,
Freie Universität Berlin, Fachbereich Biologie, Chemie,
Pharmazie, 25.08.2004 - Ausschnitt unter:
www.diss.fu-berlin.de/2004/214/Mutz.1.pdf
|
|
|
|
|
|
[74]
- Schlotzhauer, A. (2003): Untersuchung zur Gegenregulation
eukaryoter Gene in Borrelien-infizierten Endothelzellen
,Dissertation, Institut für Medizinische Mikrobiologie und
Krankenhaushygiene der MHH, Fachbereich Chemie der Universität
Hannover
|
|
|
|
|
|
[75]
- DGLN (1997): Liquor-Symposium 1997 Leipzig, DGLN /
Deutsche Gesellschaft für Liquordiagnostik und klinische
Neurochemie,
www.uke.uni-hamburg.de/extern/dgln/pdf/abstracts_97.pdf
|
|
|
|
|
|
[76]
- Zebandt, S. (2001): Etablierung und Evaluierung zweier
IgG Subklassen - ELISA für die Borreliose - Diagnostik beim
Menschen, Dissertation, Zentrum für Neurologie und
Neurochirurgie, Justus-Liebig-Universität Gießen,
http://geb.uni-giessen.de/geb/volltext/2001/444/pdf/d010046.pdf
|
|
|
|
|
|
[77]
- Celet, B., Akman-Demir, G., Serdaroglu, P., Yentur,
S.-P., Tasci, B., van Noort, J.-M., Saruhan-Direskeneli, G.
(2000): Anti-alpha B-crystallin immunoreactivity in inflammatory
nervous systemdiseases, J. Neurol. 12/2000, 247(12), 935-9,
Department of Physiology, Istanbul Medical Faculty, Istanbul
University, Istanbul, Turkey
|
|
|
|
|
|
[76]
- Unsicker, C. (2002): Induktion von Matrixmetalloproteinasen und
Interleukin-18 durch Borrelia burgdorferi in vivo und in vitro,
Dissertationfreigabe 22.10.2002, Digitale Dissertation, Freie
Universität Berlin
|
|
|
|
|
|
[77]
- DGN (2007*): Neuroborreliosie, Zusammenfassung,
www.dgn.org/106.0.html (* = Abrufdatum 21.04.2007)
|
|
|
|
|
|
[78]
- Jaenicke, L. (2004): Acylierte Cholesterolgalactoside zur
Differentialdiagnose des Lyme-Disease, Rundschau, Journal-Club,
BIOspektrum 4/04, 10. Jg., S. 370
|
|
|
|
|
|
[79]
- Burrascano, S. (2005): Advanced Topics in Lyme-Disease,
Diagnostic hints and Treatment Gudelines for Lyme and other
Tickborne illnesses, Fifteenth Editition, Eastend Medical
Associates, P.C., East Hampton, NY, International Lyme Associated
Diseases Society
|
|
|
|
|
|
[80]
- Stricker, RB., Winger, EE. (2001): Decreased CD57 lymphocyte
subset in patients with chronic Lame disease, California Pacific
Medical Center, San Francisco, USA, Immunol. Lett., Feb. 1; 76(1),
S. 43-48
|
|
|
|
|
|
[81]
- Stricker, RB., Burrascano, J., Winger, E. (2002): Longterm
decrease in the CD57 lymphocyten subset in a patient with chronic
Lyme disease, California Pacific Medical Center, San Francisco,
USA, Ann. Agric Environ Med., 9(1), S. 111-3
|
|
|
|
|
|
[82]
- Opladen, T. (2002): Untersuchung zu Veränderungen der
Lymphozytensubpopulation im Krankheitsverlauf der Mukoviszidose,
Dissertation, Medizinischen Fakultät der
Rheinisch-Westfälischen Technischen Hochschule Aachen
|
|
|
|
|
|
[83]
- Straubinger, R. (2006): >>Spirochäteninfektion unter
besonderer Berücksichtigung der direkten
Wirt-Erreger-Kommunikation am Beispiel der Lyme-Borreliose <<,
Nachwuchsgruppe Molekulare Infektionsmedizin, Forschungsbericht -
Research Report 2006, S. 291-292,
Biotechnologisch-Biomedizinisches Zentrum, Universität
Leipzig, www.uni-leipzig.de/forschung/fkst.htm
|
|
|
|
|
|
[84]
- Everding, B. (2007): CCL18 und Allergie: Die Stimmulation
dendritischerZellen mit CCL18 fördert die Th2-Immunantwort,
Inaugural-Dissertation, Medizinische Universitätsklinik,
Abteilung für Pneumologie, Albert-Ludwigs-Universität
Freiburg i. Br.,
http://www.freidok.uni-freiburg.de/volltexte/3071/pdf/CCL18undAllergie.pdf
|
|
|
|
|
|
[85]
- RKI (2007) Lyme-Borreliose: RKI-Ratgeber Infektionskrankheiten -
Merkblatt für Ärzte, FSME Impfempfehlung der STIKO,
Ratgeber Infektionskrankheiten, Epidemiologisches Bulletin Nr. 17,
Aktuelle Daten und Informationen zu Infektionskrankheiten und
Public Health, Aktualisierung vom April 2007; Erstveröffentlichung
im Epidemiologischen Bulletin 22/1999, Robert Koch Institut / RKI,
S. 148-150, http://www.rki.de
|
|
|
|
|
|
[86]
- Varwig, C. (2007): Golgwäscher im Datenfluss - Mit Data
Mining entlocken Unternehmen wie der Payback-Betreiber ihren
Kunden unbemerkt lukrative Informationen. In Internet-Foren wie
Myspace und StudiVZ stellen Millionen Nutzer ihr persönliches
Profil sogar freiwillig zur Schau., Verl. Konradin Medien GmbH,
bild der wissenschaft, 8/2007, S. 84-89
|
|
|
|
|
|
[87]
- LGA (2007): Infektionen durch Zeckenstichen,
Infektionskarnkheiten, Hygiene + Infektionsschutz,
Gesundheitsthemen, ÖGD / Öffentlicher Gesundheitsdienst,
LandesGesundheitsAmt Baden-Württemberg, (abgerufen am :
17.11.2007),
http://www.gesundheitsamt-bw.de/servlet/PB/menu/1148880_l1/index.html
|
|
|
|
|
|
[88]
- Info: Ringvorlesung >>Zeckenübertragene
Erkrankungen<<, Prof. Dr. med. Dr. rer. nat. H. Eiffert,
Bereich Humanmedizin Universität Göttingen (1/2004).
|
|
|
|
|
|
[89]
- RKI / Mehnert, W. H. (2005): Zur Situation bei wichtigen
Infektionserkrankungen in Deutschland: Neuerkrankungen an
Lyme-Borreliose im Jahr 2004 / Analyse auf der Basis der
Meldedaten aus den sechs östlichen Bundesländern,
Epidemiologisches Bulletin - Aktuelle Daten und Informationen zu
Infektionskrankheiten und Public Health, Nr. 32, S. 285-288,
12.08.05
|
|
|
|
|
|
[90]
- Narayan K, Dail D, Li L, Cadavid D, Amrute S,
Fitzgerald-Bocarsly P, Pachner AR, (2005): The nervous system as
ectopic germinal center: CXCL13 and IgG in lyme neuroborreliosis.,
University of Medicine and Dentistry of New Jersey, New Jersey
Medical School, Newark, NJ 07103, USA., Ann. Neurl. 2005, PMID:
15929033, http://www.ihop-
net.org/UniPub/iHOP/pm/11016265.html?nr=5&pmid=15929033
|
|
|
|
|
|
[91]
- Rauch, J. (2008) Grüner Star / Glaukom trotz niedrigem
Augendruck, Medinfo, Bild der Wissenschaft, Verl. Deutsche
Verlagsanstalt GmbH - Stuttgart, S. 36 u. 37, J. 1/08, ISSN
0006-2375
|
|
|
|
|
|
[92]
- Vaar, R. (2008): Aufrüstung fürs Gehirn / Taube hören,
Blinde sehen und Lahme gehen - die moderne Neurotechnologie
verwirklicht biblische Verheißungen. Und sie macht sich
daran, ganze Hirnareale nachzubauen oder zu erweitern., Verl.
Konradin Medien GmbH, bild der wissenschaft, S. 30-33, 9/08
|
|
|
|
|
|
[93]
- Kraft, U. (2008): Neue Stars am Hirnforscherhimmel / Seit dem
19. Jahrhundert hielt man sie für reinen Nervenkitt - die
Glazellen im Gehirn. Jetzt wird Forschern klar: Der Kitt denkt
mit!, Verl. Konradin Medien GmbH, bild der wissenschaft, S. 20-26,
9/08
|
|
|
|
|
|
[94]
- Kraft, U. (2008): Magdalena Götz: die Entdeckerin / Wie
werden Nervenzellen gebildet? Um diese Frage dreht sich das
Forscherleben von Magdalena Götz. Jetzt hat sie entdeckt,
dass dabei die lange verkannten Gliazellen die Hauptrolle
spielen., Verl. Konradin Medien GmbH, bild der wissenschaft, S.
27-29, 9/08
|
|
|
|
|
|
[95]
- Miklossy, J., Kasas, S., Zurn, A. D., McCall, S., Yu, S.,
McGeer, P. L. (2008): Persisting atypical and cystic forms of
Borrelia burgdorferi and local inflammation in Lyme
neuroborreliosia, Journal of Neuroinflammation 2008, 5:40doi:
10.1186/1742-2094-5-40, www.jneuroinflammation.com/content/5/1/40
|
|
|
|
|
|
[96]
- Spreer, A. (2008): Die MRZ-Reaktion in der Diagnostik
chronisch-entzündlicher Erkrankungen, 2. Liquorsymposium
Dresden, 26. April 2008 - Veranstalter: Medizinisches Labor
Dresden/Elsterwerda, Vortrag zum Thema von: Dr. med. A. Spreer,
Neurochemisches Labor Uni Göttingen, Notizen von: Dr. med. D.
Hillscger – Mitglied der Arbeitsgruppe Borreliose der
Sächsischen Landesärztekammer, Labor + Diagnostik,
Schwerpunktthema Neurroborreliose - mit Fachbeiträgen der
Deutschen Borreliose Gesellschaft e.V., Borreliose Wissen aktuell,
BFBD / Borreliose u. FSME Bund Deutschland e.V. -
Patientenorganisation Bundesverband, Okt. 2008, Nr. 18, S. 8
|
|
|
|
|
|
[97]
- Schwarzbach, A. (2009): Ursachen des „Gulff War I-Syndrom“,
Militärisches Institut für Molekulare Medizin, Prof.
Nicolson, ILADS 2008 zu Diagnostik, Ein Kongressbericht von Armin
Schwarzbach, Forschung, Borreliose Wissen aktuell, S.37, Nr. 19,
Febr. 2009, Borreliose und FSME Bund Deutschland
|
|
|
|
|
|
[98]
- Schmidt, F.-P., von Baehr, V., Gaida, B., Hugo, F., Andressohn,
P., Tregel, M., Endres, A.-S. (2007): Was kann die HLA-Bestimmung
bei der Diagnostik und Beurteilung des Verlaufes einer Borreliose
leisten?, Diagnostik-Info 214 , Ärzte für Labormedizin (
Mikrobiologie / Infektionsepidemiologie / Transfusionsmedizin /
Hämostaseologie - Institut für Medizinische Diagnostik,
05.09.2007
|
|
|
|
|
|
[99]
- Hildenbrand, P., Craven, D.E., Jones, R., Nemeskal, P.
(2009): Lyme Neuroborreliosis: Manifestations of a Rapidly
Emerging Zoonosis, American Journal of Neuroradiology, Published
ahead of print on April 3, 2009, doi: 10.3174/ajnr.A1579,
http://www.ajnr.org/cgi/content/full/30/6/1079
|
|
|
|
|
|
[100]
- Nau, R., Christen, H.-J., Eiffert, H. (2009):
Lyme-Borreliose – aktueller Kenntnisstand, Dtsch Arztebl.
Int. 2009; 106(5): 72-81, Archiv, Medizin: cme, DOI:
10.3238/arztebl. 2009.0072,
http://www.aerzteblatt.de/V4/archiv/artikel.asp?id=63176
|
|
|
|
|
|
[101]
- Lünemann, J.D., Gelderblom, H., Sospedra, M.,
Quandt, J.A., Pinilla, C., Marques, A., Roland, M. (2007):
Cerebrospinal Fluid-Infiltrating CD4+ T Cells Recognize Borrelia
burgdorferi Lysine-Enriched Protein Domains and Central Nervous
System Autoantigens in Erlay Lyme Encephalitis, American Society
fpr Microbiology, Infect and Immunity, January 2007, p. 243-251,
Vol. 75, No. 1, oo19-9567/07/$08.00+0, doi:10.1128/IAI.01110-06
|
|
|
|
|
|
[102]
- Kegel, B. (2009): Epigenetik – Wie Erfahrungen
vererbt werden, DuMont Buchverlag, Köln, 2. Aufl., ISBN
978-3-8321-9528-1
|
|
|
|
|
|
[103]
- UniPort (2010): Protein names: Chaperone protein htpG /
Gene names: htpG / BB0560, Reviewed, UniPortKB/Swiss-Port P42555
(HTPG_BORBU),Last modified January 19, 2010, Version 68,
http://www.uniprot.org/uniprot/P42555
|
|
|
|
|
|
[104]
- Myers, T.A., Kausal, D., Philipp, M.T. (2009): Microglia
Are Mediators of Borrelia burgdorferi–Induced Apoptosis in
SH-SY5Y Neuronal Cells, Division of Bacteriology &
Parasitology, Tulane National Primate Research Center, Tulane
University Health Sciences Center, Louisiana, United States of
America, Funding:
This work was supported by grants NS048952 and RR00164 from the
National Institutes of Health, The funders had no role in study
design, data collection and analysis, decision to publish, or
preparation of the manuscript, Competing
interests:
The authors have declared that no competing interests exist,
Copyright:
© 2009 Myers et al. This is an open-access article
distributed under the terms of the Creative Commons Attribution
License, which permits unrestricted use, distribution, and
reproduction in any medium, provided the original author and
source are credited, Received:
May 11, 2009; Accepted:
October 19, 2009; Published:
November 13,, PLoS Pathog 5(11): e1000659. doi:10.1371/journal.
ppat. 1000659,
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2771360/
|
|
|
|
|
|
[105]
-
boj/dpa (2011): Programmierte Beute - Pilz macht Ameisen zu
Zombies - Eine Pilzart im brasilianischen Dschungel lockt Ameisen
ins Verderben, indem sie das Verhalten ihrer Beute steuert: Sporen
der Pilze wachsen in den Kopf der Insekten - die daraufhin ihrem
Tod entgegenkrabbeln. 03.03.2011, Spiegel-online, Wissenschaft,
Natur,
http://www.spiegel.de/wissenschaft/natur/0,1518,748833,00.html#ref=rss
|
|
|
|
|
|
[106]
-
Weis, N., Pelikan, J., Tanner, M. (2006): Parasitenmoleküle
können den Wirt beeinflussen, Blockkurs "Infektionsbiologie
und Epidemiologie“, 20.01.2006, Schweizerisches
Tropeninstitut, http://www.infektionsbiologie.ch/seiten/home.html
|
|
|
|
|
|
[107]
-
Brinar, W., Habek, M. (2010): Ms-Abgrenzen gegen
Infektionskrankheiten, University of Zagreb, School of Medicine
and University Hospital Centre Zagreb, Department of Neurology and
Refferal Center for Demyelinating Diseases of the Central Nervous
System, Zagreb, Croatia, Rare infections mimicking MS., Clin
Neurol Neurosurg., 2010, Sep; 112(7): 625-8., Epub 2010 May 2.,
http://www.ncbi.nlm.nih.gov/pubmed/20439131
|
|
|
|
|
|
[108]
- UniPort (2011): Chaperone protein htpG / Heat shock protein
htpG, High temperature protein G / Gene Locus BB_0560 - Borrelia
burgdorferi (Lyme disease spirochete), p42555 (HTPG_BORBU)
Reviewed, UniPortKB/Swiss-Prot, Last modified November 16, 2011,
Version 80, http://uniprot.org/uniprot/P42555
|
|
|
|
|
|
[109]
- Superfamily (2011): heat shock protein 90 (Borrelia garinii
Pbi), Genomes garinii Pbi - ref. YP_072999.1, gi. 51598811, home:
http://supfam.cs.bris.ac.uk/SUPERFANILY/cgi-bin/gene.cgi?genome=ga&seqid=gi
| 51598811 | ref| YP_072999.1 (Stand: 04.05.2011)
|
|
|
|
|
|
[110]
- Taipale, M., Daniel, F., Lindquist, J and S. (2010): HSP90 at
the hub of protein homeostasis: emerging mechanistic, nature
Reviews molecular Cell Biology | AOP, published online 9 June
2010; doi: 10:1038/nrm2818,
http://web.wi.mit.edu/linquist/pub/PDFs/Taipale2010NRMCB.pdf
|
|
|
|
|
|
[111]
- Locatelli, g., Wörtge, S., Buch, T., Ingold, B., Frommer,
F., Sobottka, B., Krueger, M., Karram, K., Bühlmann, C.,
Bechmann, I., Heppner, F. L., Waisman, A., Becher, B. (2012):
Primary oloigodendrocyte death does not elicit anti-CNS immunity,
Nature Neuroscience, 26.02.12, Doi: 10.1038/nn.3062
|
|
|
|
|
|
[112]
- Fugger, L. (2012): Gene link to multiple sclerosis explains drug
side effect, University of Oxford media news,
http://www.ox.ac.uk/media/news_releases_for_Journalisten/120709.html
|
|
|
|
|
|
[113]
- jes (2008): Wirtschaft stiftet Ostasien-Professur - fünf
Unternehmen beteiligt / Figura: „Wichtiges Signal für
Universität“, Wirtschaft & Wetter, Göttinger
Tageblatt, S. 32, 17.05.2008
|
|
|
|
|
|
[114]
- Miklossy J, Khalili K, Gern L, Ericson RL, Darekar P, Bolle L,
Hurlimann J- Paster BJ - J Alzheimers Dis 2004 Dec;6(6):639-649.
Borrelia burgdorferi persistiert im Gehirn bei chronischer
Lyme-Neuro-Borreliose und kann mit M. Alzheimer in Verbindung
gebracht werden.
|
|
|
|
|
|
[115]
- http://geb.uni-giessen.de/geb/volltexte/2000/255/index.html
(uni:nbn:hebis:26-opus-2558)
|
|
|
|
|
|
[116]
- Sievers, M. (2008): Borreliose - die „Lues“ (Syphilis)
der Moderne, 43. Fortbildungskongress der Ärztekammer am 26.
Januar 2008, Vortrag zum Thema von: Prof. Dr. M. Sievers,
Hochschule Wädenswill - Institut für Pharmazeutische
Biotechnologie, Schweiz, Notizen von: Szasz, P., Strayle, D. u.
Welker, C., Forschung, Schwerpunktthema Neurroborreliose - mit
Fachbeiträgen der Deutschen Borreliose Gesellschaft e.V.,
Borreliose Wissen aktuell, BFBD / Borreliose u. FSME Bund
Deutschland e.V. - Patientenorganisation Bundesverband, Okt. 2008,
Nr. 18, S. 28
|
|
|
|
|
|
[117]
- Heinz, T. (2014): Axonaler Schaden im Mäusegehirn nach
intraventrikulärer Infusion des OspC von Borrelia
burgdorferi, 05.04.20114, DBG / Deutsche Borreliose-Gesellschaft
e.V. - vereinigt Wissenschaftler und Ärzte, die
sich mit der Borreliose und assoziierten Infektionskrankheiten
befassen, 11. Jahrestagung d. DBG e.V., Erfurt 04.-05.
April 2014
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Weitere
Informationsquellen siehe unter >>Quellen
/ weiterführende Literatur / Internet<<
|
|
|
|
|
|
|
|
|
|
|
|
[A]
- Paramedizin: von der Schulmedizin abweichende
Auffassungen - ich (A. Hartwig) nutze
den Begriff da er teilweise unter den klassischen Schulmedizinern
für Seiten wie meiner Homepage genutzt wird. Ich ziehe mir
gerne den Schuh an, teilweise eine nicht ganz so enge Sichtweise
wie die Schulmedizin mein Eigen zu nennen. Da ich aber dem engeren
Kreis der Mediziner nicht angehöre, bitte ich einen Jeden
meine Meinung zum Thema Multiple Sklerose (MS)
und Lyme-Borreliose (Bb. /
low-dose-borreliosis) sehr kritisch zu betrachten. Ich
erhebe daher auch nicht den Anspruch, für das
Niedergeschriebene auf dieser Homepage
(www.borreliose-zecken-ms.de), alles
streng wissenschaftlich ausgewertet zu haben. Ich möchte mit
dieser Seite nur quergedachtes Gedankengut verbreiten und
eventuell neue Ideen liefern, eine Beurteilung und Prüfung
muss jeder an meiner Homepage Interessierte für sich selbst
durchführen. Ich hoffe aber, dass ich einen kleinen
interessanten Beitrag zum MS-Syndrom beitragen konnte.
|
|
|
|
|
|
[B]
- folgende Laborwerte werden als Normalwerte bzw. als
Schwellenwert eingestuft [6]:
|
|
|
|
|
|
<
25 U/ml GM1 (Ganglioside = phospahtfreie
sogenannte Sphingolipide, welche zu den Glycolipiden gehören
die vorrangig im Nervensystem [ZNS u. PNS] vorkommen.)
|
|
|
|
|
|
<
3 U/ml Bb.-AK IgG (Enzym-Immuno-Assay / EIA)
|
|
|
|
|
|
<
3 U/ml Bb.AK IgM (Enzym-Immuno-Assay / EIA)
|
|
|
|
|
|
Bb.-IgM
/ Bb.-IgG Immunoblot negativ wenn alle folgenden kD-Banden nicht
nachweisbar sind: 83-, 75-, 66-, 58-, 41-, 39-, 37-, 34-, 31-,
30-, 29-, 25-, 21- u. 18-kD
|
|
|
|
|
|
Zu
den Borrelia-kD-Banden siehe auch Seite: Gegenüberstellung
der Molekulargewichtsspuren - B. Genotyp 1 / B. Genotyp 2
|
|
|
|
|
|
[C]
- Datengegenüberstellung zum Nachdenken:
|
|
|
|
|
|
Einwohnerzahlen:
USA ca. 300.000.000 / BRD ca. 82.000.000 (Quelle:
Internet, Statistische Ämter der Staaten)
|
|
|
|
|
|
MS-Kranke:
USA: 30.000 = ca. 0,1 % d. Bevölkerung / BRD 120.000 = ca.
1,6 % d. Bevölkerung (Quelle [13])
|
|
|
|
|
|
Vergleicht
man die Zahlen (USA/BRD), dann fällt
einem sofort auf das die Verbreitung bezogen auf die
Einwohnerzahlen (Prävalenz) des
MS-Syndrom in den USA wesentlich geringer ist als in Deutschland.
Dies könnte eventuell damit begründet werden, dass die
USA wesentlich mehr Klimazonen aufweist. Oder aber weil in den USA
fast ausschließlich Borrelia-Geno-Typ 1 (Borrelia
burgdorferi sensu stricto / Bb.ss.)
vorkommt. Genotyp 1(Bb.ss.)
wird weniger mit Komplikationen an den Nerven und dem Gehirn in
Verbindung gebracht. Hingegen ist in Deutschland (Europa)
als Haupt-Subspezies Borrelia-Geno-Typ 2 (Borrelia
garinii / Bb.sl.)
verbreitet, welcher in erster Linie mit nervlichen
Erkrankungen und Erscheinungen am ZNS in Verbindung gebracht wird.
Nachfolgend die für Deutschland ermittelte Durchseuchungsrate
der Zecken, unterschieden nach den einzelnen
Haupt-Borrelia-Geno-Typen des Borrelia
burgdorferi sensu lato Komplexes (Bb.sl.-Komplex
= Erreger der Lyme-Borreliose):
|
|
|
|
|
|
Mittlere
Zecken-Durchseuchungsrate in Deutschland [14]:
B. garinii 39 %,
B. afzelli 37 %,
B. burgdorferi ss. 15
% und die restlichen 9 % verteilen sich auf die anderen Borrelien
des Bb.sl.-Komplex
- z.B. Borrelia valaisiana
[15],
Borrelia spielmani [16] usw.
(siehe auch Seite: Merkblatt, Abs.:
Borrelien, Klassifizierung und Subspezies)
|
|
|
|
|
|
[D]
- Prädisposition / Disposition (Diathese):
Faktor der eine Erkrankung begünstigt, z.B. Alter,
Geschlecht, Vorerkrankung, Bereitschaft für ein krankhaftes
Geschehen, erbliche Veranlagung (Genotyp)
die eine gewisse Empfänglichkeit für einen
Krankheitserreger stellt (kommt man mit dem
entsprechenden Erreger in Kontakt, erkrankt man an ihm. Kommt man
mit dem Erreger nicht in Kontakt, bleibt man gesund).
|
|
|
|
|
|
[E]
- Humane Herpesviren
(HHV): HHV1 = Herpes simplex Virus
1 (HSV1), Herpes Simplex Virus
2 (HSV2), Varicella-Zoster-Virus
(VZV o. HHV3),
Epstein-Barr-Virus (EBV o. HHV4),
Cytomegalie-Virus (CVM o. HHV5),
humanes Herpesvirus 6 (HHV6),
humanes Herpesvirus 7 (HHV7)
und humanes Herpesvirus 8 (HHV8).
|
|
|
|
|
|
[F]
- Ist Sloweniens Gesundheitssystem ein Modell für eine
bessere präventive Diagnostik, als das z.B. bei uns in
Deutschland installierte Gesundheitssystem mit seinen bekannten
Schwächen? Jeder mag sich
selber an den nachfolgenden Fakten über das Gesundheitssystem
Sloweniens ein Bild machen. Können wir in Punkto
Gleichstellung des Patienten (Bundesbürger) in Deutschland
noch etwas von den Slowenen lernen?
|
|
|
|
|
|
Sloweniens
Gesundheitssystem [36]:
|
|
|
|
|
|
-
Gleich nach der Unabhängigkeit von Jugoslawien (1992)
hat SLO eine Pflichtversicherung eingeführt, in der der Staat
eine zentrale Rolle spielt.
|
|
|
|
|
|
-
Alle Slowenen sind nur bei einer Krankenkasse pflichtversichert
(nationale Einheitskasse), die einer
zentralen staatlichen Kontrolle unterliegt .
|
|
|
|
|
|
-
Eine Befreiung von der Versicherungspflicht gibt es nicht.
|
|
|
|
|
|
-
Prävention hat einen festen Platz im Gesundheitssystem
Sloweniens, nach dem Vorbild des von Bismarck ins Leben gerufene
Sozialsicherungssystem.
|
|
|
|
|
|
-
Auch die Versicherung gegen Arbeitsunfälle und
Berufskrankheiten wird über die nationale Einheitskasse mit
versichert.
|
|
|
|
|
|
-
Die Unternehmen (Arbeitgeber) müssen sich in betriebliche
Prävention engagieren, dazu zählen Reihenuntersuchungen
und Gesundheitsschecks.
|
|
|
|
|
|
-
Die meisten SLO-Ärzte arbeiten als öffentlich
Angestellte in Gesundheitsstationen und Polikliniken.
|
|
|
|
|
|
-
Die Erstversorgung geschieht in den Gesundheitszentren, dort
arbeiten unter einem Dach Allgemein- u. Zahnmediziner, Kinder- u.
Freuenärzte sowie Physiotherapeuten und Apotheken. Fachärzte
arbeiten vorallem in den Polikliniken, bei bedarf aber auch i.d.
Gesundheitszentren.
|
|
|
|
|
|
-
Die Gesundheitsstationen beschränken sich auf Notfallmedizin,
Kinderheilkunde und Diagnostik.
|
|
|
|
|
|
-
Für die Weiterbehandlung beim Facharzt (z.B.
Poliklinik) bedarf es einer Überweisung. Die
öffentlichen Angestellten-Verträge der Ärzte
beinhalten das Präventionsziel, erreicht ein Arzt diese
nicht, kann das vereinbarte Honorar gekürzt werde.
|
|
|
|
|
|
-
Alle Allgemeinmediziner müssen in Siebenjahresrhythmus ihre
Qualifikation nachweisen, in dem sie anerkannte
Fortbildungsveranstaltungen besuchen.
|
|
|
|
|
|
-
Eventuell abgeschlossene Zusatzversicherungen fangen
Zuzahlungslasten auf, die von der normalen nationalen
Einheitskasse nicht abgedeckt werden. 70 % der Slowenen verfügen
über eine solche Zusatzversicherung, der größte
Anbieter ist ein Tochterunternehmen der nationalen Einheitskasse.
Die Zusatzversicherung/en müssen keine Gewinne
erwirtschaften.
|
|
|
|
|
|
[G]
- Island gilt zusammen mit den Faröer Inseln
als vermeintlicher Beweis dafür das es sich bei der MS um
eine Infektionserkrankung handelt, da das MS-Syndrom dort erst in
Folge der Besatzung durch Militärtruppen (GB
u. USA) nach dem 2. Weltkrieg auftrat [40].
Die Frage die sich stellt , wurden hierbei dort vorher nicht
vorkommende Viren, Chlamydien, ein weiterer Borrelia-Genotyp (z.B.
mit Schiffsratten) oder aber ein anderer noch nicht
identifizierter Krankheitskeim eingeschleppt. Auch ein neu
eingeschleppter Borrelia-Genotyp könnte eine Erklärung
sein, wenn eventuell nur eine Bb,-Genotyp-Mischinfektion zum
MS-Syndrom führt. Vielleicht ist aber auch nur ein
Bb.-Genotyp für die MS verantwortlich und dieser kam vorher
nicht auf den Inseln vor. Eventuell bedarf es aber auch einer
Chlamydien, Borrelien und MRZ-Viren Mischinfektion
dafür das die MS-Syndrom in Erscheinung tritt. Auch bei
diesem Modell wäre es denkbar das vorher ein Kandidat der
potentiellen MS-Erreger nicht auf den Inseln beheimatet war, somit
das MS-Syndrom unter der Bevölkerung nicht in Erscheinung
trat. Ein ganz anderes Modell wäre, wenn das Erscheinen der
MS auf den Inseln vielleicht mit dem Einschleppen eines neuen
Zecken- bzw. Borrelien-Wirtstier (z.B.
Ratten u. Mäuse) zusammenhängt. Die Folge,
eventuell eine andere Antigenstruktur auf der Oberfläche der
Borrelien beim Übertragen auf den Menschen, so das sie
leichter in ihre Zielorgane (z.B. ZNS)
gelangen. Bei der anderen Antigenstruktur könnte es sich z.B.
um eine andere Osp-A oder Osp-C Varianten handeln, es sind derzeit
ca. 7 Osp-A und über 70 verschiedene Osp-C-Varianten bekannt
(siehe auch Seite: Gegenüberstellung
der Molekulargewichtsspuren B. Genotyp 1 / B. Genotyp 2).
|
|
|
|
|
|
[H]
- Weiter wird der Erreger inzwischen mit folgende
Erkrankungen in Verbindung gebracht [41/48/49]:
Endokarditis (Herzinnenhaut- u.
Herzklappenentzündung), Parikarditis
(Herzbeutelentzündung),
Vaskulitis (Gefäßentzündung/en),
Atheromatose / Atherosis (Veränderung
der Gefäßinnenwände bzw. Intima),
Arteriosklerose (Verhärtung u.
Verdickung der Arterien u. Gefäße), Aneurysma
(Aufdehnung der Gefäßwandschichten),
Hypertension / Hypertonie (Blutdruckerhöhung
durch Versteifung u. Verhärtung der großen Arterien),
Uveitis (insbs. Erkrankung der Ader- u.
Regenbogenhaut des Auges), reaktiver Arthritis
(wiederkehrende vorübergehende
Gelenkentzündung/en), Erythema nodosum (Hautrötung
mit Knotenbildung bes. an Streckseiten d. unteren Extremitäten,
einhergehend mit Fieber), Pyoderma-Gangenosa (Entzündung
der Talk- u. Schweißdrüsen, meist sich bogenförmig
ausbreitend), Sarkoidose (Lymphknotenschwellung
u. Lungenparenchymbefall), Asthma bronchiale (akute
anfallsartige Luftnot), chronische obstruktive
Lungenerkrankung (COPD / ständige
Erkrankung der Lunge) und Hämoptysen (Bluthusten).
|
|
|
|
|
|
Einige
Autoren bringen Chlamydia pneumoniae auch mit nachfolgenden
Erkrankungen in Zusammenhang (z.B. [41]):
Optischer Neuritis (Sehnerventzündung),
Radiculitis / Radikuloneuritis (Nervenwurzelentzündung),
Querschnittsmelitis / Myelitis transversa (diffuse
Entzündungsherde im Rückenmark),
Riesenzellen-Arteriitis / Arteriitis temporalis
(Autoimmunaggresionskrankheit der Arterien
im Schläfenbereich), Darm-Dysepepsie (Bauchschmerzen
ohne nachweisbare organische Ursache), Wagener`s Granuloma
/ G. Gangraenescens (nekrotisierende
Schleimhautentzündung der Atmungsorgane mit Bluthusten),
Primär sklerosierende Cholangitis / PSC (autoimmune
Lebererkrankung insbs. Mit Veränderung der Gallenwege),
Reiter-Syndrom / Reiter-Krankheit (Symptomkomplex:
Gelenkschmerzen, Bindehautentzündung, Harnröhren- u.
andere Schleimhautentzündungen), Behcet-Syndrom /
Behcet`s-Krankheit (schubweise verlaufende,
sept.-allerg. Erkrankung mit Lichtscheu), Interstitieller
Cystitis / Interstitielle Zystitis (Frauenkrankheit:
chronische Entzündung der Blasenwand [I]),
wiederkehrende Fistel-in-ano (Kanal i.d.
Haut des Anus/After beginnend von einem Abszess),
Polyarteritis-Nodosa / Periarteritis nodosa (generalisierte
allerg. hyperg. Arteriitis z.B. mit Befall der Niere) Multiple
Sklerose (MS) und Morbus Alzheimer
(DAT). Multiple Sklerose und M.
Alzheimer werden allerdings noch sehr kontrovers diskutiert [40].
|
|
|
|
|
|
[I]
- Wird heute auch als mögliche Erkrankung der Männer
angesehen (Bez. dann: chronische
Prostatitis), ist durch einfache Untersuchung des Urins
nicht zu diagnostizieren [50].
|
|
|
|
|
|
[J]
- Vorgeschlagene Antibiose bei akuter
Chlamydien-Erkrankung z.B. wie folgt (nach
[48]):
|
|
|
|
|
|
·
Erwachsene: 2 g Doxycylin oder Erythromycin tägl. für
2-3 Wochen, alternativ 1,5 g Azithromycin tägl. über 5
Tage
|
|
|
|
|
|
·
Kinder: Erythromycin-Saft (40 mg/Kg)
über 10-14 Tage
|
|
|
|
|
|
·
Chinolone wie Gemifloxacin sollen auch gut wirksam sein bei
Pneumonie (Lungenentzündung)
|
|
|
|
|
|
Der
Erfolg der Therapie soll an einer Besserung der Symptome und
sinkenden Antikörpertiter gemessen werden können.
Persistierende Chlamydiae-Infektion trotz Antibiose sind nicht
auszuschließen, z.B. in zirkulierende Monozyten [48].
Eine Behandlungen mit falschen Antibiotika kann eine
persistierende (fortbestehende)
Chlamydien-Infektion begünstigen, bei chronischen
Infektionen reicht die Antibiotikum-Konzentration von
normalerweise verabreichten Antibiotika selbst bei einer
vierwöchigen Behandlung nicht aus. Die sogenannten
intrazellulären Retikularkörperchen der Chlamydien
hören bei bestimmten Immunstressbedingungen mit ihrer Teilung
(Vermehrung) auf, z.B. bei bestimmter
Interferon Gamma (INF-g)
Konzentration, bei essentiellen Nährstoffentzug (z.B.
bestimmte Aminosäuren) und bei der Anwesenheit
bestimmter Antibiotika. Das bedeutet nicht das diese für
immer deaktiviert sind, unter günstigeren
Umgebungsbedingungen, auch nach langer Zeit, können die
persistierenden Chlamydien-Retikularkörperchen wieder
aktiv (reaktiviert) werden [52].
|
|
|
|
|
|
Prognostizierte
Behandlung bei chronischer persistierender Chlamydia
pneomoniae (Chlamydien-Syndrom) [41]:
|
|
|
|
|
|
Bei
der Antibiose solle drauf geachtet werden das alle Lebens-Zyklen
und Phasen des Organismus abgedeckt werden, der Zeitplan sollte in
etwa wie folgt aussehen:
|
|
|
|
|
|
·
600 - 1200 mg NAC (N-acetyl-Cysteine)
2 x pro Tag / ununterbrochene Einnahme für 12 Monate -
beginnend mit 600 mg, steigernd auf 1200 mg bei guter
Verträglichkeit
|
|
|
|
|
|
·
wenn NAC vertragen wird sollte 100 mg Doxycyclin 1 x tägl.
hinzugefügt werden - ununterbrochene Einnahme für 12
Monate
|
|
|
|
|
|
·
wenn die beiden Mittel (NAC u. Doxycyclin)
vom Patienten vertagen werden den beiden Therapeutika 3 x pro
Woche 250 mg Azithromycin (alternativ 150 mg
Roxithromycin) hinzufügen - bis zum Ende der
12-Monatstherapie so beibehalten
|
|
|
|
|
|
·
wenn alle drei Therapeutika gut vertragen werden, die Doxy-Dosis
auf 200 mg pro Tag erhöhen - die langsame Steigerung soll
anfänglich starke Reaktion (z.B.
Herxheimer-Reaktion) auf absterbende Bakterien vermeiden
|
|
|
|
|
|
·
drei Monate nach dem Beginn der Therapie mit einer
zusätzlichen Behandlung mit Metronidazole (o.
Tinidazol) einsetzen, anfangs nur 1 x alle drei Woche,
später (bei Verträglichkeit)
auf 5 Tage alle drei Wochen aufstocken - Verabreichung 400 mg 3 x
am Tag
|
|
|
|
|
|
·
ab Ende des 12. Monats alle Therapeutika mit entsprechender
Unterbrechung in 2-Monatsintervallen bis zum Ende des 20. Monats
nach Therapiebeginn verabreichen.
|
|
|
|
|
|
Die
Therapie sollte bei persistierender Erkrankung über ein Jahr
erfolgen, eine 6-8 Wochen andauernde Antibiose, nur auf der Basis
eines Antibiotikums (z.B. Doxycyclin)
muss als ungenügend eingestuft werden. Hiermit soll es nicht
gelingen alle Chlamydien zu erreichen, vielmehr sollen
hierdurch die persistierenden Erreger noch tiefer in den
Organismus gedrängt werden [41].
So herrscht über die Antibiose Art (Mono-Therapie
o. Kombi-Therapie) und Dauer durchaus geteilter Meinung
unter den Fachleuten, ähnlich wie bei der persistierenden
low-dose-borreliosis (Lyme-Borreliose).
Trotz der bekannten Behandlungsschwierigkeiten wurden Studien
mittels Mono-Antibiose durchgeführt, um zu beweisen das MS
nicht durch Chlamydia pneumoniae verursacht wird. Die
Versuche wurden teilweise so bewertet, wenn das MS-Syndrom nicht
durch das verabreichte Antibiotikum verschwand, das dann wohl auch
keine Bakterien (z.B. Chlamydia
pneumoniae) für das Ausbrechen der MS
verantwortlich gemacht werden können. Doch muss sicherlich
zurecht gefragt werden, ob z.B. eine achtwöchige Antibiose
mit täglicher Verabreichung von 300 mg Roxithromycin für
einen obligat intrazellulären Erreger ausreichend ist [51]
- müssen somit diese “halbherzigen“ Studien nicht
generell in Frage gestellt werden?
|
|
|
|
|
|
[K]
- Das Gefäßsystem besteht in seiner Gesamtheit
aus den Blut- u. Lymphleitbahnen. Uns interessieren hier insbs.
die Blutgefäße, die zusammen mit den entsprechenden
Organen (Herz, Lunge, Leber usw.) das
Blutkreislaufsystem bilden. Den sogenannten kleinen und großen
Blutkreislauf sowie den Pfortaderkreislauf. Der “große
Blutkreislauf“ geht von der linken Herzkammer aus und ist der
Sauerstofftransporteur. Der “kleine Blutkreislauf“
beginnt an der rechten Herzkammer und bringt das Abfallprodukt
(Kohlendioxid) des Körpers zum
Abatmen in die Lunge - deswegen auch Lungenkreislauf genannt. Dann
gibt es noch den sogenannten “Pfortaderkreislauf“ (Vena
portae), der im engeren Sinn eigentlich kein geschlossener
Kreislauf ist, da die Pfortader (Vene)
das Blut von Magen, Darm, Bauchspeicheldrüse und Milz sammelt
und zur Leber leitet. Die Pfortader ist ein Teil des gesamten
Blutkreislaufs. Häufig wird der Begriff (Nomenklatur)
“Pfortaderkreislauf“ auch für andere ähnlich
aufgebaute Gefäß-Systeme verwendet, z.B. für die
Venen im Hypophysen-Zwischenhirn-System. Die Blut-Gefäße
des Blutkreislaufsystems werden aufgeteilt in Arterien (=
Schlagadern), Venen (= Blutadern)
und Kapillaren / Veneolen (= sogen.
Haargefäße o. Mikro-Blutgefäße).
|
|
|
|
|
|
Arterien
(Arteria) sind die Blutgefäße
die das Blut vom Herzen wegleiten (abgesehen
vom Lungenkreislauf), sie führen sauerstoffreiches,
hellrotes Blut. Die größten Arterien (Haupt-
o. Lungenschlagader) können einen Durchmesser von zwei
bis drei Zentimeter haben, an ihrem verästelten Enden gehen
Arterien in die Kapillaren (Mikro-Blutgefäße)
über. Die Wandung der Arterien besteht aus drei Schichten
(der sogen. Intima, Media u. Adventitia),
in der sogen. Media befindet sich elastisches Gewebe und sogen.
glattes Muskelgewebe. Je nachdem welcher Gewebetyp vorherrscht,
glatte Muskulatur oder elastisches Gewebe, unterscheidet man in
elastischen oder muskulären Arterien-Typ. Die großen
Arterien (z.B. Schlagadern) werden
vorrangig aus dem elastischen Typ gebildet, da sie die Pulswellen
des Herzens auffangen (dämpfen)
müssen. Die kleinen Arterien hingegen werden in erster Linie
aus dem muskulären Typ gebildet, da sie die Fähigkeit
besitzen müssen sich zu erweitern oder zu verengen -
jenachdem wie das zu versorgende Organ Blutzufuhr benötigt.
Die Arterienmuskulatur (glatte Muskulatur)
wird über die vegetativen Nerven gesteuert, die in der
sogenannten bindegewebigen Adventitia zusammen mit kleinsten
Gefäßen (Mikro-Blutgefäße,
Kapillaren) verlaufen. Fazit: liegt eine Störung der
Nerven oder der kleinsten Blutgefäße vor, kann es in
der Folge zur Blutdruckerhöhung kommen.
|
|
|
|
|
|
Venen
(lat. Blutadern) sind die Blutgefäße
die zum Herzen hin führen. Das Venensystem bildet meist ein
Geflecht, so dass das rückströmende Blut an einigen
Stellen meist mehrere Wege nutzen kann. Die Venen bestimmen die
Richtung des Blutkreislaufs durch Ventilklappen (sogen.
Intimafalten) die den Blutfluss nur in eine Richtung
zulassen. Es gibt Hauptvenen (z.B. in den
Gliedmaßen), Arterien-Begleitvenen, tiefliegende und
an der Oberfläche verlaufende sowie Verbindungsvenen. Auch
die Venen bestehen aus drei Schichten (der
sogen. Intima, Media u. Adventitia) wie die Arterien, die
aber i.d.R. wesentlich dünner sind (insbs.
die Media) als bei Arterien gleichen Durchmessers. Eine
kleine Ausnahme ist bei den Venen in der Schädelhöhle zu
beobachten, deren Wandungen nur aus dem Endothel der harten
Hirnhaut gebildet wird. In den Venen sind die Pulswellen des
Herzens nicht mehr wirksam, sie sind teilweise an feste Gebilde
angeheftet so das sie normalerweise nicht zusammenfallen können.
Der Umgebungsluftdruck (Luftdruckschwankungen,
Wetterwechsel etc.) wirkt auf Venen ein die unmittelbar
unter der Hautoberfläche liegen - ist hier eine Verbindung zu
Wetterbedingten (z.B. Föhnwetterlage im
Alpenvorland etc.) Migräneattacken bzw.
Kopfschmerzanfällen.
|
|
|
|
|
|
Kapillaren
(Mikro-Blutgefäße) sind
feinste Verästelungen in den Organen, Muskeln und sonstigen
Zellgewebe, sie weisen i.d.R. außerordentlich dünne
Wände (Epithel) auf damit sie
die Zielzellen der Organe mittels Diffusion mit Sauerstoff und
Nährstoffen versorgen können. Umgekehrt nehmen sie das
Kohlendioxid und Stoffwechselprodukte auf. Vereinfacht gesagt
stellen sie den Übergang zwischen Venen und Arterien dar. Die
Kapillaren (präkapillare Arterien o.
Arteriolen / Mikro-Blutgefäße) haben häufig
nur einen Durchmesser von 0,01 Millimeter.
|
|
|
|
|
|
[L]
- Gram-Färbung (engl. Gram´s
stain, Gram stain o. Gram staining procedure) benannt nach
H.-C. Gram (dänischer Bakteriologe /
1853-1928):
|
|
|
|
|
|
Die
Gram-Färbung gilt als eine der wichtigsten Färbungen in
der medizinischen Mikrobiologie, sie dient der Darstellung von
Bakterien in der Lichtmikroskopie. Mittels dem Anfärbverhalten
(Gram-Färbung) werden Bakterien
in grampositiv und gramnegativ klassifiziert. Im Prinzip kann man
mit dem Anfärbverhalten zeigen wie die Bakterienwände
aufgebaut sind. So bilden zugegebene Anilin-Farbstoffe mit Jod
zusammen Komplexe in der Bakterienwand, enthält diese nur
eine Schicht Peptidoglykan (PG o. PGN /
Murein) können die Farbstoffkomplex mittels Alkohol
ausgewaschen werden. Enthält die Zellwand hingegen mehrere
Schichten Peptidoglykan, kann der Farbstoffkomplex nicht mehr
komplett aus der Zellwand rausgewaschen werden. Beim sogenannten
Peptidoglykan (Murein) handelt es
sich um verknüpfte Stränge zweier
Zuckerdervitatmoleküle, N-Acetylglucosamin und
N-Acetylmuraminsäure. Die quervernetzten Stränge dieser
Zuckerdervitatmoleküle umspannenden als flächiges Netz
die Bakterienoberfläche (sogen.
Murein-Sacculus), von diesen Murein-Netzen können
mehrere Schichten durch sogenannte Oligopeptide verbunden sein. Im
Wesentlichen ist das Murein bei allen Bakterien gleich aufgebaut,
mit kleinen Abweichungen. Bei grampositiven Bakterien sind die
Variationen meist stärker ausgeprägt. Auf das
Murein-Netzwerk wirken einige Antibiotika (z.B.
Penicillin u. Vancomycin) ein, sprich, sie greifen in das
Zusammenspiel der verschieden Enzyme ein die das Murein-Netzwerk
zusammenhalten. Wird das Enzym-Zusammenspiel gestört, weitet
sich das Murein-Netzwerk und das entsprechende Bakterium platzt.
Somit sagt die Anfärbbarkeit (Gram-Färbung)
eines Bakteriums schon etwas über dessen
Antibiotika-Erreichbarkeit aus.
|
|
|
|
|
|
Vorgang
der Gram-Färbung: 1.- Anelin-Farbstoff in die Probe geben,
einwirken lassen und nach einiger Zeit mit Wasser spülen. 2.-
Jodhaltige Lösung (sogen. Lugolsche
Lösung) in die Probe geben, einwirken lassen und auch
ausspülen. 3.- Die Probe mit 96prozentigen Alkohol spülen
bis keine Farbe mehr abgegeben wird. Bakterien mit mehrschichtiger
Peptidoglykan-Zellwand lagern den Farbstoff zwischen diesen
Schichten ein, wodurch keine komplette Fentfärbung geschieht.
Diese Bakterien bezeichnet man dann als grampositiv (=
blau gefärbte Bakterien). 4.- Erscheint das Bakterium
nicht grampositiv, erfolgt eine sogenannte Gegenfärbung mit
dem Farbstoff Fuchsin. Nach dem Einwirken des Farbstoffes Fuchsin
wird die Probe erneut mit Wasser abgespült, enthält die
Bakterien-Zellwand nun eine Schicht Peptidoglykan erscheint das
Bakterium rot - gramnegativ (= rot gefärbte
Bakterien). Grampositive Bakterien haben eine
Zellwandstärke von ca. 20-80 nm, gramnegative Bakterien eine
Zellwandstärke < 10 nm.
|
|
|
|
|
|
[M]
- Mitochondrien gelten als die Kraftwerke und
Energielieferanten der Zellen, da in ihnen aus Glucose und anderen
energiereichen Nährstoffen Energie in Form von
Adenosintriphosphat (ATP) gewandelt
wird. Bei diesem Vorgang spricht man von der sogenannten
ATP-Synthese. Die ATP-Synthese ist im Prinzip ein Energiewandler,
der eine Energieform in eine Andere transformiert. Das Enzym ATP
spielt bei fast allen Organismen eine zentrale Rolle, da ATP
i.d.R. ununterbrochen als Energieüberträger benötigt
wird. ATP wird von den anderen Zellorganellen für deren
chemische Reaktionen gebraucht.
|
|
|
|
|
|
Im
Zellinneren gibt es voneinander abgetrennte Bereiche die dafür
sorgen das die verschiedenen chemischen Reaktion getrennt
ablaufen, sogenannte Zellorganellen: Mitochondrien (Kraftwerke
u. Energielieferanten Þ
ATP-Synthese), Ribosomen (Eiweißfabriken
Þ Aufbau d. Zellmembran o.
Enzyme), endoplastische Retikulum (ER
/ Þ produziert u.
speichert eine Vielzahl von Substanzen), Golgi-Apparat /
Golgi-Vesikel (Eiweiß-Speicher u.
-Aufbereiter Þ
Übergabestelle vom Innern der Zelle nach Außen oder
umgekehrt), Zellskelett / Zytoskelett (Bewegungs-
u. Stützfunktion d. Zelle Þ
besteht aus Eiweißfasern sog. Mikrofilamente u. hohlen
Eiweißstäbchen sog. Mikrotubuli = Transportwege im
Innern d. Zelle), Zentralkörperchen / Zentriolen
(spielt eine wichtige Rolle bei d.
Zellteilung), Zilien (Ausstülpungen
auf der Oberfläche mancher Zellen Þ
Transportweg über die Zelloberfläche hinweg).
|
|
|
|
|
|
[N]
- MRT oder MRI-Verfahren (magnetic
resonance imaging) sind
weitläufiger als Kernspinresonanztomographie bekannt. Dies
ist ein computergestütztes bildgebendes Verfahren, bei dem
mittels Magnetfeld mit hoher Feldstärke, Protonen der Wasser-
u. Fettbestandteile im Organismus angeregt werden.
|
|
|
|
|
|
Gadolinium:
(Gd)-Komplexverbindung (Seltenerdmetall)
wird als Kontrastverstätker beim MRT-Verfahren eingesetzt.
Mit Gd können auch schwächere Unterschiede (Anomalien)
besser und kontrastreicher sichtbar gemacht werden
|
|
|
|
|
|
[O]
- Fas Antigen / Fas Ligand Regelkeis: Fas (FAS)
ist ein Molekül welches Zellen in den Selbstmord (Apoptose)
treibt, es gehört zur Familie der
Tumornekrosefaktor-Zelloberflächenproteine (APO-1
u. CD95). Das Fas-Molekül ist ein
Zelloberflächenrezeptor, der an der Übertragung der
durch T-Lymphozyten ausgelösten Apoptose (Selbstmord)
beteiligt ist. FasL (Fas Ligand)
gehört zur selben Gruppe von Membranproteinen. Das
Fas/FasL-System ist als Auslöser für den Zellselbstmord
bei Immunzellen und auch bei verschiedenen fetalen und adulten
Geweben beteiligt. Fas ist in Tumoren (Karzinomen)
meist supprimiert und FasL hochreguliert. Fas / FasL ist nach
großer Wahrscheinlichkeit an der Autoimmunhepatitis
(autoreaktive Lebererkrankung) und an
der endokrinen Autoimmunität, vorallem bei der
Bauchspeicheldrüse (Pankreas)
und der Schilddrüse (Glandula
thyroidea) beteiligt. Der endokriner Teil der
Bauchspeicheldrüse bildet normalerweise z.B. in den so
genannten Langerhans-Inseln Insulin und Glukagon, die beiden
wichtigsten Hormone der Blutzuckerregulierung, und gibt sie an das
Blut ab. Die Endokrine (Hormone) der
Schilddrüse, Triiodthyronin (T 3)
und Thyroxin (T 4), zu dessen
Synthese Jod gebraucht wird, regulieren den Grundumsatz und die
individuelle Energieproduktion, die zur Erhaltung der
Organfunktionen notwendig ist.
|
|
|
|
|
|
[P]
- Dendritische
Zelle/n (DC
/ DCs) sind nach heutigem Wissen auch maßgeblich
an allergischen Reaktionen beteiligt (siehe
z.B. [84]).
Durch die DCs wird eine spezielle Untergruppe der T-Lymphozyten
(T-Zell-Subpopulation),
nämlich die T-2-Helferzellen (TH2-Zellen)
verstärkt aktiviert. Die TH2-Zellen produzieren dann, nach
Aktivierung, die chemischen Botenstoffe (Interleukine
/ IL) IL-4, IL-5, IL-10 u. IL-13 (siehe
“Merkblatt“, Abs. “Tarnstrategien“: “Lähmung
der antigenpräsentierenden Immunzellen durch Allergien“)
. Diese Botenstoffe sind bei Allergikern in erhöhten
Konzentrationen nachweisbar, unter anderem regen sie die
Produktion von Immunglobulin-E-Antikörpern an (IgE).
Diese E-AK sind nach derzeitigem immunologischen Verständnis
stark an allergischen Reaktionen beteiligt. Dendritische
Zellen reifen (mutieren)
nach der Aufnahme (phagozytieren)
von intrazellulären Bakterien zu “DC 1“-Zellen und
veranlassen in Folge T-Lymphozyten (T-Zellen)
dazu sich zu TH1-Zellen zu entwickeln, kommen die DCs mit eine
entsprechenden Allergen (Peptide
bzw. kurze Eiweißmoleküle) in Kontakt
(Makropinozytose),
reifen sie zu “DC 2“-Zellen heran und fördern eine
vermehrte TH2-Zellen-Entwicklung sofern eine genetische
Disposition vorliegt. Es spielen aber auch andere Faktoren eine
Rolle bei der Reifung von DCs, so z.B. LPS (Lipopolysaccharide
- Zellwandbestandteil von gramnegativer Bakterien),
SEB (Staphylokokenentertoxine
B) und eine Kombination aus TNF-a,
IL-1 und PGE2 als auch virale Produkte und
Doppelstrang-RNA zur Reifung (Maturierung).
So wie eine Allergie wahrscheinlich Einfluss auf den Verlauf einer
Borreliose haben kann, so können umgekehrt wohl auch die
Borrelien eine indirekte Wirkung auf die DCs und die
Auslösung einer Allergie haben. da es sich bei ihnen auch um
sogen. gramnegative Bakterien handelt.
|
|
|
|
|
|
[Q]
- Makrophagen
werden zur Gruppe der sog. Fresszellen (Phagozyten)
gezählt, es sind Immunzellen die den weißen
Blutkörperchen (Leukozyten)
zugeordnet werden. Makrophagen werden zur ältesten
Antigen-Vermittler-Gruppe der angeborenen zellulären
Immunabwehr gerechnet, da Makrophagen-artige Zellen schon in der
Taufliege (Drosophila)
gefunden wurden. Makrophagen entstammen dem Knochenmark, von wo
sie als Monozyten in den Blutkreislauf auswandern und dort bis zum
Kontakt zu einem Antigen (z.B. Bakterien
usw.) zirkulieren. Makrophagen erkennen mittels
entsprechender Rezeptoren (Kontaktstellen)
körperfremde Antigene wie Proteine u./o. Glycoproteine von
Bakterien und Viren und nehmen diese dann in sich auf, dort werden
sie dann aufbereitet und dessen entsprechende Strukturen
(Antigen-Peptide) zusammen mit einem
körpereigen-Molekül (MHC-II-Faktor)
an ihrer Oberfläche anderen Immunzellen präsentiert.
Nach einem entsprechenden Antigen-Kontakt wandern sie verstärkt
in den entsprechenden betroffenen infizierten Bereich (Organ,
Gewebe etc.) ein, wo sie sich dann unter Einwirkung von
Zytokinen (Wachstums- u.
Differenzierungs-Substanzen) zu echten Makrophagen wandeln.
Je nach Zielgebiet und Stimulierung nehmen sie dann verschiedene
Formen an: unter den Einfluss von T-Helferzellen können sie
zu Epitheloidzellen (verzahnte
Zellmembranen) differenzieren, um größere
Antigene (z.B. Bakterien wie Borrelien)
aufzunehmen können sie zu sogen. Riesenzellen verschmelzen
und im ZNS werden sie zu den oben beschriebenen Mikrogliazellen.
Man hat den Makrophagen je nach Vorkommen unterschiedliche
Nomenklaturen gegeben: Knochen = Osteoklasten, Knorpel =
Chondroklasten, Haut = Langerhans-Zellen, Bindegewebe = Histozyten
u. Antischkow-Zellen (z.B. Aschoff-Knötchen
bzw. rheumatischen Granulom), ZNS = Mikrogliazellen, Leber
= Kupfer-Sternzellen, Lunge = Alveolamakrophagen, Plazenta =
Hofbauerzellen, Muttermilch = Lysozym-Makrophagen und bei
Fett-Stoffwechsel-Störungen werden die stark veränderten
sich in den Blut-Gefäßen ablagernden Makrophagen
Schaumzellen genannt, letztere können dann als Folge zur
Arteriosklerose führen.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|